(1)在新生代的海水里有一种铁细菌 它们提取海水中的亚铁离子 把它转变成它们的皮鞘(可以用Fe2O3
| (1)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;这个用酶为催化剂的反应的另一个反应物是CO2,它在反应后转变成有机物,可用甲醛来表示,试写出配平的离子方程式。 (2)地球化学家用实验证实,金矿常与磁铁矿共生的原因是:在高温高压的水溶液(即所谓“热液”)里,金的存在形式是[AuS-]络离子,在溶液接近中性时,它遇到Fe2+离子会发生反应,同时沉积出磁铁矿和金矿,试写出配平的化学方程式。 |
参考解答
| (1)CO2+4Fe2++5H2O=CH2O+3Fe2O3+8H+ (2)2AuS-+3Fe2++4H2O=2Au+Fe3O4+2H2S+4H+ |
CH2O中C的氧化数为0,[AuS-]中Au的氧化数为+1,Fe3O4中Fe的平均氧化数为+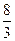 。 。(1)CO2+4Fe2++5H2O=CH2O+3Fe2O3+8H+ (2)2AuS-+3Fe2++4H2O=2Au+Fe3O4+2H2S+4H+ |
相似问题
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯 其变化可表述为____KClO3+_
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为____KClO3+____HCl(浓)=____KCl+____ClO2↑+____Cl2↑+____H2O(1) 请配平
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫 该反应中氧化过程
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O - 2e- → SO42- + 4H
在MnO2和浓盐酸的反应中 如果有17.4 g MnO2被还原 那么参加反应的氯化氢有多少克?被氧化
在MnO2和浓盐酸的反应中,如果有17 4 g MnO2被还原,那么参加反应的氯化氢有多少克?被氧化的氯化氢的物质的量是多少?(已知:)
在反应8NH3 + 3Cl2= 6NH4Cl + N2中 被氧化的氨与未被氧化的氨的物质的量之比为:
在反应8NH3 + 3Cl2= 6NH4Cl + N2中,被氧化的氨与未被氧化的氨的物质的量之比为:() A.8∶3 B.6∶1C.3∶1D.1∶3
工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍 一般先用硫酸溶解合金 使其转化为Fe2+ Co
工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金,使其转化为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉












