工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍 一般先用硫酸溶解合金 使其转化为Fe2+ Co
工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金,使其转化为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液.反应的部分化学方程式如下(A为还原剂):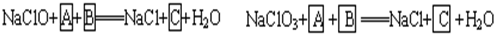 试回答下列问题: (1)上述反应中,A为:______(写化学式,下同),C为:______. (2)配平下列离子方程式: 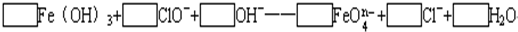 (3)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______,FeO
(4)根据(2)、(3)推测FeO
A.Cl2 B.SO2C.H2S D.O2 |
参考解答
| (1)根据题意知,次氯酸钠和氯酸钠都是氧化剂,A是还原剂,则A失电子化合价升高,且溶液中含有硫酸,所以A中含有硫酸根离子且具有还原性,结合实验目的把Fe2+氧化为Fe3+从而使Fe3+转化为某种沉淀析出知,A是硫酸亚铁,B是硫酸,结合元素守恒知,C是硫酸铁, 故答案为:FeSO4,Fe2(SO4)3; (2)该反应中铁元素的化合价+3→+(8-n),失去(5-n)个电子,氯元素的化合价+1→-1价,得到2个电子,得失电子的最小公倍数是2(5-n),所以氢氧化铁的计量数是2,次氯酸根离子的计量数是5-n,然后根据原子守恒配平方程式得 2Fe(OH)3+(5-n)ClO-+2nOH-=2 FeO4n-+(5-n)Cl-+(n+3)H2O, 故答案为2、5-n、2n、2、5-n、n+3; (3)2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(n+3)H2O转移电子 214g 2(5-n)×6.02×1023 3.21g 5.42×1022 n=5-
故答案为:2,+6; (4)FeO42-中铁元素化合价是最高价,所以该离子具有强氧化性,能和强还原性的物质反应,氯气和氧气具有强氧化性,所以不能和高铁酸根离子反应,二氧化硫和硫化氢具有强还原性,所以能和高铁酸根离子反应,故选B、C. |
相似问题
据悉 第16届中国广州亚运会在上使用的发令枪所用的“火药”成分是氯酸钾和红磷 经撞击发出响声 同时产
据悉,第16届中国广州亚运会在上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:KCl
在反应5 NH4NO32 HNO3 +4 N2↑+9 H2O 中 氧化产物与还原产物的物质的量之比为
在反应5 NH4NO32 HNO3 +4 N2↑+9 H2O 中,氧化产物与还原产物的物质的量之比为A.5∶3B.3∶5C.1∶1D.2∶1
在 K2Cr2O7 + 14HCl='===' 2KCl + 2CrCl3 + 3Cl2?+ 7H2
在 K2Cr2O7 + 14HCl= "=== " 2KCl + 2CrCl3 + 3Cl2?+ 7H2O反应中。(1)元素被氧化,是氧化剂,氧化产物是;(2)此反应若转移了12mol的电子,则生成氯气L(标准状况)
关于反应中的先后顺序 下列评价正确的是( )A.向浓度都为0.1mol·L-1Na2CO3和NaO
关于反应中的先后顺序,下列评价正确的是()A.向浓度都为0.1mol·L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应B.向NH4Al(SO4)2溶液中滴加少量的
亚硝酸钠(NaNO2)又称工业盐 其外观类似食盐 但有剧毒.近年来 建筑工地多次发生民工误食工业盐而
亚硝酸钠(NaNO2)又称工业盐,其外观类似食盐,但有剧毒.近年来,建筑工地多次发生民工误食工业盐而中毒的事件.利用如下反应可鉴别NaNO2和NaCl._____












