在MnO2和浓盐酸的反应中 如果有17.4 g MnO2被还原 那么参加反应的氯化氢有多少克?被氧化
在MnO2和浓盐酸的反应中,如果有17.4 g MnO2被还原,那么参加反应的氯化氢有多少克?被氧化的氯化氢的物质的量是多少?(已知: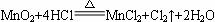 ) ) |
参考解答
| 29.2 g 0.400 mol |
从元素的化合价变化分析可知,4摩尔氯化氢只有2摩尔被氧化,设参加反应的氯化氢物质的量为x,则被氧化的氯化氢为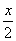 ,将17.4 g MnO2换算为0.2 mol,列比例计算如下: ,将17.4 g MnO2换算为0.2 mol,列比例计算如下: 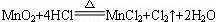 1 mol 4 mol 0.2 mol x 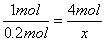 ,解得:x='0.800' mol。则 ,解得:x='0.800' mol。则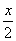 ='0.400' mol。 ='0.400' mol。0.800 mol的氯化氢的质量为0.800 mol×36.5 g·mol-1='29.2' g。 |
相似问题
在反应8NH3 + 3Cl2= 6NH4Cl + N2中 被氧化的氨与未被氧化的氨的物质的量之比为:
在反应8NH3 + 3Cl2= 6NH4Cl + N2中,被氧化的氨与未被氧化的氨的物质的量之比为:() A.8∶3 B.6∶1C.3∶1D.1∶3
工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍 一般先用硫酸溶解合金 使其转化为Fe2+ Co
工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金,使其转化为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉
据悉 第16届中国广州亚运会在上使用的发令枪所用的“火药”成分是氯酸钾和红磷 经撞击发出响声 同时产
据悉,第16届中国广州亚运会在上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:KCl
在反应5 NH4NO32 HNO3 +4 N2↑+9 H2O 中 氧化产物与还原产物的物质的量之比为
在反应5 NH4NO32 HNO3 +4 N2↑+9 H2O 中,氧化产物与还原产物的物质的量之比为A.5∶3B.3∶5C.1∶1D.2∶1
在 K2Cr2O7 + 14HCl='===' 2KCl + 2CrCl3 + 3Cl2?+ 7H2
在 K2Cr2O7 + 14HCl= "=== " 2KCl + 2CrCl3 + 3Cl2?+ 7H2O反应中。(1)元素被氧化,是氧化剂,氧化产物是;(2)此反应若转移了12mol的电子,则生成氯气L(标准状况)












