某小组同学为探究H2O2 H2SO3 Br2氧化性强弱 设计如下实验(夹持仪器已略去 装置的气密性已
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。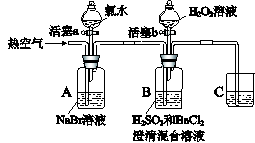 实验记录如下:
请回答下列问题: (1)A中反应的离子方程式是 。 (2)实验操作II吹入热空气的目的是 。 (3)装置C的作用是 ,C中盛放的药品是 。 (4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式 。 (5)由上述实验得出的结论是 。 (6)实验反思: ①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是 。 ②实验操作III,开始时颜色无明显变化的原因是(写出一条即可): 。 |
参考解答
| (16分,每空2分) (1)2Br-+Cl2=Br2+2Cl- (2)吹出单质Br2 (3)吸收尾气 NaOH溶液 (4)H2O2+2Br-+2H+=Br2+2H2O (5)氧化性:H2O2>Br2>H2SO3 (6) ① 不干扰,无论热空气是否参加氧化H2SO3,只要观察到产生白色沉淀的同时无明显颜色变化,即能证明Br2氧化了H2SO3 ② H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可) |
试题分析:(1)氯水中的Cl2置换Br ̄。 (2)利用Br2的挥发性,吹入热空气使Br2挥发。 (3)因为Cl2、Br2有毒,所以C中盛放NaOH溶液,除去尾气中的有毒气体,防止污染环境。 (4)混合液逐渐变成红棕色,说明H2O2把Br ̄氧化为Br2,配平可得离子方程式。 (5)根据氧化剂的氧化性大于氧化产物,可知:H2O2>Br2>H2SO3。 (6)①溶液无明显颜色变化,说明Br2参加了反应,即氧化了H2SO3。 ②实验操作III发生的反应为H2O2氧化Br ̄,开始时颜色无明显变化,说明反应收到了影响,H2SO3有剩余、H2O2浓度小、Br-与H2O2反应慢等都是可能因素。 |
相似问题
已知反应:2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3③I
已知反应:2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3③I2+SO2+2H2O=H2SO4+2HI,判断下列物质的还原能力由强到弱的顺序是()A.I->Fe2+>Cl->SO2
已知下列反应①;②;③试判断下列物质的氧化性强弱顺序正确的是A.B.C.D.
已知下列反应①;②;③试判断下列物质的氧化性强弱顺序正确的是A.B.C.D.
Fe2+ SO32-和I-都具有还原性.为了比较其还原性强弱 进行以下探究并回答:(1)已知:①还原
Fe2+、SO32-和I-都具有还原性.为了比较其还原性强弱,进行以下探究并回答:(1)已知:①还原性:SO32->Fe2+;②FeSO3难溶于水.(2)在(1)的基础上
向FeI2 FeBr2的混合溶液中通入适量氯气 溶液中某些离子的物质的量变化情况如图所示.已知:2F
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2.则下列说法中不
已知:2BrO3- +Cl2='Br2' +2ClO3-;5Cl2 +I2 +6H2O ='2HIO
已知:2BrO3- +Cl2="Br2" +2ClO3-;5Cl2 +I2 +6H2O ="2HIO3" +10HCl;ClO3- +5Cl- +6H+ =3Cl2+3H2O下列物质氧化能力强弱顺序为A.ClO3->B












