向FeI2 FeBr2的混合溶液中通入适量氯气 溶液中某些离子的物质的量变化情况如图所示.已知:2F
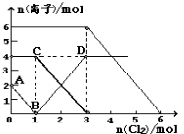
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2.则下列说法中不正确的是( )
 |
参考解答
| A、反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确; B、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气 的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量 是6mol,即FeBr2的物质的量为3mol,故B不正确; C、当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故C正确; D、碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确. 故选B. |
相似问题
已知:2BrO3- +Cl2='Br2' +2ClO3-;5Cl2 +I2 +6H2O ='2HIO
已知:2BrO3- +Cl2="Br2" +2ClO3-;5Cl2 +I2 +6H2O ="2HIO3" +10HCl;ClO3- +5Cl- +6H+ =3Cl2+3H2O下列物质氧化能力强弱顺序为A.ClO3->B
常温下 在溶液中可发生以下反应:①16H+ + 10Z-+ 2XO4- ='=' 2X2+ + 5Z
常温下,在溶液中可发生以下反应:①16H+ + 10Z-+ 2XO4- ="=" 2X2+ + 5Z2 + 8H2O,②2M2+ + R2 ="=" 2M3+ + 2R-,③2 R- + Z2 ="
将32gCu与一定浓度的硝酸混合 二者正好完全反应。产生的NO2 NO混合气体在标准状况下的体积为1
将32gCu与一定浓度的硝酸混合,二者正好完全反应。产生的NO2、NO混合气体在标准状况下的体积为11 2 L。(1)分别写出Cu和HNO3反应过程的化学方程式:,
下列反应中水只表现还原性的是( )A.2Na2O2+2H2O=4NaOH+O2↑B.2Na+
下列反应中水只表现还原性的是( )A.2Na2O2+2H2O=4NaOH+O2↑B.2Na+2H2O=2NaOH+H2↑C.2H2O 2H2↑+ O2↑D.2F2+2H2O=4HF+ O2↑
下列排列顺序正确的一组是 ( )A.粒子半径:Fe
下列排列顺序正确的一组是()A.粒子半径:Fe(OH)3胶粒>I->Na+>F-B.氧化性:MnO>Fe3+>Cu2+>Zn2+C.酸性:H3PO4<H2CO3<H2SiO4<H2SO4D.热稳定性:NaHC












