在氯氧化法处理含CN-的废水过程中 液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分
| 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。 (1)某厂废水中含KCN,其浓度为650 mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2  KOCN+2KCl+H2O。被氧化的元素是___________。 KOCN+2KCl+H2O。被氧化的元素是___________。(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:KOCN+KOH+Cl2  CO2+N2+KCl+H2O CO2+N2+KCl+H2O(3)若处理上述废水20 L,使KCN完全转化为无毒物质。至少需液氯 g。 |
参考解答
(1)碳(或C)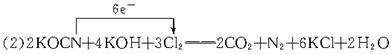 (3)35.5 |
| 本题结合含CN-的废水处理,考查氧化还原反应的基本概念、配平、标出电子转移的方向和数目,根据方程式进行定量计算,属中等题。何种元素价态升高谁即被氧化,不难分析。要配平方程式,同样从元素价态的升降、电子得失守恒考虑。标电子转移方向和数目可用单线桥或双线桥表示,但必须区分两者,第(3)题可根据两个方程式找出KCN与Cl2的总量关系求出。 (1)在KCN+2KOH+Cl2  KOCN+2KCl+H2O反应中,氯元素价态降低,H、N、O、K四种元素的价态没变,只有碳元素的价态升高,故被氧化的为碳元素。 KOCN+2KCl+H2O反应中,氯元素价态降低,H、N、O、K四种元素的价态没变,只有碳元素的价态升高,故被氧化的为碳元素。(2)氧化还原方程式的配平,首先要找准变价元素,再利用化合价升降法配平,反应物KOCN中N的价态升高,KOCN为还原剂,氯气为氧化剂。 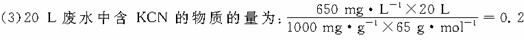 mol,由两步反应的化学方程式得出关系式:2KCN~5Cl2,所以需氯气:0.2 mol× 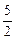 ='0.5' mol,即35.5 g。 ='0.5' mol,即35.5 g。 |
相似问题
在FeS2 + O2 → Fe2O3+ SO2反应中 还原剂与还原产物的物质的量之比为A.2:5
在FeS2+ O2 → Fe2O3+ SO2反应中,还原剂与还原产物的物质的量之比为A.2:5B.1:4C.2:1D.1:2
已知反应:5HClO3+6P+9H2O=5HCl+6H3PO4 用双线桥表示出此反应中电子转移的方向
已知反应:5HClO3+6P+9H2O=5HCl+6H3PO4,用双线桥表示出此反应中电子转移的方向和数目____________ 。
Cu20是不溶于水的碱性物质 能溶于酸发生歧化反应 生成Cu和Cu2+.测Cu20在矿石中含量的方法
Cu20是不溶于水的碱性物质,能溶于酸发生歧化反应,生成Cu和Cu2+.测Cu20在矿石中含量的方法为:将矿石溶于足量的Fe2(S04)和H2S04的混合溶液中,然后用
某一反应体系中的物质有:HCl SnCl2 H2SnCl6 As H3AsO3 H2O 已知:HCl
某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一.(1)写出并配平该反应的化学方程式:______.(2)在该反应中
化合物X是产量大 应用广的二元化合物 大量用作漂白剂 饮水处理剂 消毒剂等。年产量达300万吨的氯酸
化合物X是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。年产量达300万吨的氯酸钠是生产X的原料,92%用于生产X—在酸性水溶液中用












