化合物X是产量大 应用广的二元化合物 大量用作漂白剂 饮水处理剂 消毒剂等。年产量达300万吨的氯酸
| 化合物X是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。年产量达300万吨的氯酸钠是生产X的原料,92%用于生产X—在酸性水溶液中用盐酸、二氧化硫或草酸还原。此外,将亚氯酸钠固体装柱,通入用空气稀释的氯气氧化,也可生产X。X有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反应。 ⑴写出X的分子式和共轭π键( 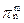 )。 )。⑵分别写出上述用草酸还原和用氯气氧化生产X的反应方程式。 ⑶写出上述X歧化反应的化学方程式。 |
参考解答
⑴ ClO2 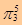 ⑵2ClO3-+ H2C2O4 + 2H+ = 2ClO2 + 2CO2 + 2H2O 或 2NaClO3 + H2C2O4 + H2SO4 = 2ClO2 + 2CO2 + Na2SO4 + 2H2O 2NaClO2+ Cl2 = 2ClO2 + 2NaCl NaClO2是固体,不能写成ClO2-。 ⑶2ClO2 + 2NaOH= NaClO2 + NaClO3 + H2O 或 2ClO2 + 2OH-= ClO2-+ ClO3-?+ H2O |
| ⑴根据X的制法:由氯酸钠还原,及亚氯酸钠氧化,可知X是Cl(Ⅳ)的氧化物,即ClO2,同时X的制法也可证明之。 X有顺磁性,成单电子位于形成π键中,所以存在三中心五电子Π键。 ⑵利用氧化还原配平方法可配平以上两方程式。但需要注意使用亚氯酸钠制备ClO2时,因为是固相中的反应,因此不能写成离子方程式的形式。 ⑶在碱性溶中,Cl(Ⅳ)岐化生Cl(Ⅴ)和Cl(Ⅲ),生成ClO2-和ClO3-离子,然后利用氧化还原方程式的配平方法,配平该反应方程式。 |
相似问题
(6分)用足量的NaOH溶液将448mlCl2(标准状况)完全吸收 计算①生成的NaClO的物质的量
(6分)用足量的NaOH溶液将448mlCl2(标准状况)完全吸收,计算①生成的NaClO的物质的量;②该反应中氧化剂与还原剂的物质的量之比;③该反应中电子转移总数。
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中 1molCuS
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化磷的物质的量是( ) A.2 5 molB.1 5 molC.11 5 molD.1 3 mol
(1)在标准状况下 3.55g氯气的体积是______L 将其与氢气完全化合需氢气的物质的量是___
(1)在标准状况下,3 55g氯气的体积是______L,将其与氢气完全化合需氢气的物质的量是______mol,将生成的气体制成100mL溶液,溶质的物质的量浓度是____
(13分)我国是世界上发现和使用铜及铜器最早的国家之一 直到现在铜及其化合物在工农业生产中仍然有着广
(13分)我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。(1)工业上可以用黄铜矿(主要成分Cu
储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒 这种碳
储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应,式为:C












