(13分)我国是世界上发现和使用铜及铜器最早的国家之一 直到现在铜及其化合物在工农业生产中仍然有着广
| (13分)我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。 (1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下: ① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2 在③中被氧化与被还原元素原子的物质的量之比为 ;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为 。 (2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式 。 (3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费, 为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程: 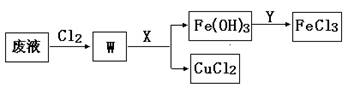 ①试剂Y的名称 ;物质X最好是 (填化学式)。 ②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol· 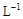 , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7) , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7) |
参考解答
| (13分) (1)1﹕6 (2分), 7.5mol(3分,没单位扣1分)。 (2)Cu2O+2H+=Cu+Cu2++H2O (2分,没配平扣1分,化学式错0分) (3)①盐酸或氯化氢(1分);CuO (2分)。② 3.0—4.3(3分) |
试题分析:(1) Cu2S+ 2Cu2O='6Cu+' SO2中,被氧化的元素即化合价升高的元素是S元素,被还原的元素即化合价降低的元素是Cu元素,由方程式可知,③中被氧化与被还原元素原子的物质的量之比为1:6; 由①得6CuFeS2~12O2~3Cu2S; 由②得 2Cu2S ~ 3O2~2Cu2O, 由③Cu2S~ 2Cu2O~6Cu,所以最终得关系式6CuFeS2~15O2~6Cu,若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为7.5mol; (2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,根据氧化还原反应理论,蓝色溶液为硫酸铜溶液,红色固体为单质铜,离子方程式为Cu2O+2H+=Cu+Cu2++H2O; (3)①由氢氧化铁生成氯化铁,需要试剂Y是稀盐酸或氯化氢;加入X的目的是调节溶液pH,使铁离子沉淀,所以为了不引入新的杂质,X最好选择CuO; ②加入氯气后铜离子的浓度仍是0.5mol/L,铁离子的浓度为1.0mol/L,根据所给沉淀的溶度积计算氢氧化铁完全沉淀时的c(OH-)3=1.0×10—38 /1.0×10—5mol· 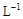 , 则c(OH-)=1.0×10—11mol· , 则c(OH-)=1.0×10—11mol·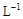 , pH=3;当铜离子开始沉淀时,c(OH-)2=2.0×10—20 /0.5=4.0×10—20mol· , pH=3;当铜离子开始沉淀时,c(OH-)2=2.0×10—20 /0.5=4.0×10—20mol·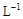 ,c(OH-)=2.0×10—10mol· ,c(OH-)=2.0×10—10mol·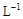 ,pH=4.3,所以铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀时溶液对pH的范围是3.0—4.3。 ,pH=4.3,所以铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀时溶液对pH的范围是3.0—4.3。 |
相似问题
储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒 这种碳
储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应,式为:C
FeS与一定浓度HNO3反应 生成Fe(NO3)3 Fe2(SO4)3 NO2 N2O4 NO和H2
FeS与一定浓度HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、、NO物质的量之比4﹕1﹕4,参加反应的FeS与HNO3物质的量之比A.2∶15B.1∶6C.2∶3D.16∶25
(1)2KClO3MnO2.△2KCl+3O2↑(请用双线桥表示其电子转移情况)(2)______K
(1)2KClO3MnO2 △2KCl+3O2↑(请用双线桥表示其电子转移情况)(2)______KMnO4+______HCl(浓)-______KCl+______MnCl2+______Cl2↑+______H2O(配平
下列反应中 哪些元素被氧化?哪些元素被还原? 用双线桥法标出电子得失数目 指出氧化剂 还原剂。(1)
下列反应中,哪些元素被氧化?哪些元素被还原? 用双线桥法标出电子得失数目,指出氧化剂、还原剂。(1) 2KNO3+3C+SK2S+N2↑+3CO2↑___________________
有下列6种物质:Na2SO4 Na2SO3 K2SO4 I2 H2SO4 KIO3组成一个氧化还原反
有下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,请回答下列问题:(1)将这6种物质分别填入下面对应的横线上,组成一个未












