(12分)【选做题】本题包括A B两小题 请选定其中一小题 并在相应的答题区域内作答。若多做 则按A
| (12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。 A.[物质结构与性质] 下表为元素周期表的一部分,其中的字母代表相应的元素。
(2)元素c、d、e、f的第一电离能(I1)由小到大的顺序为 。(用相应元素的元素符号表示) (3)表中所列的元素之间可以形成多种无机化合物和有机化合物,则它们形成的化合物之一——邻甲基苯甲醛的分子中碳原子轨道的杂化类型为 。 1 mol 苯甲醛分子中含有σ键的数目为 。 (4)元素d与e形成的化合物常用于制作 材料,其原因是 。 (5)表中有关元素形成的一种离子和单质d3互为等电子体,则该离子的化学式为 。 (6)元素I的合金可用来储存a的单质,该合金的晶胞结构如图所示,则此合金的化学式为 。 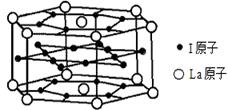 |
参考解答
| 共12分。 (1)3d5(2分) (2)Al<Mg<O<N(2分) (3)sp2和sp3(2分) 14 mol或14NA(1分) (4)耐火(1分) 晶体的晶格能较大(1分) (5)NO2—(1分) (6)LaNi5(2分) |
试题分析:根据元素周期表可判断a~(1)根据元素周期表可判断h是Co元素,原子的外围电子的排布式为3d74s2,所以四价阳离子的外围电子排布式为3d5 (2)元素c、d、e、f分别是N、O、Mg、Al元素,N与O比,N的2p轨道是2个电子为半充满状态,所以第一电离能N>O;Mg与Al,Mg的最外层是3s轨道,有2个电子,为全充满状态,所以第一电离能Mg>Al,而电子层数越多,第一电离能越小,所以四种元素的第一电离能的大小顺序是Al<Mg<O<N; (3)邻甲基苯甲醛的分子中苯环、醛基上的碳原子的周围有3个σ键,是sp2杂化,甲基上的碳原子周围是4个σ键,是sp3杂化;单键都是σ键,双键有1个是σ键,所以1 mol 苯甲醛分子中含有σ键的数目为14 mol或14NA; (4)元素d与e形成的化合物是MgO,常用作耐火材料,因为MgO的晶格能较大,它的熔点高,所以被用作耐火材料; (5)单质d3即O3,是3原子18个价电子的分子,与它互为等电子体的离子的判断,应在O元素的周围找,所以应是NO2-; (6)元素I是Ni元素,上下底面各有6个Ni原子,侧面有 6个Ni原子,内部形成正六边形的有6个Ni原子,所以晶胞中Ni的原子个数=18×1/2+6=15;La原子位于六棱柱的顶点和上下底面的中心,所以晶胞中La原子的个数=12×1/6+2×1/2=3;所以晶胞中Ni与La的原子个数比是15:3=5:1,该晶胞的化学式为LaNi5。 |
相似问题
短周期元素X Y Z W Q在元素周期表中的相对位置如图所示。下列说法正确的是 ( )A.元
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是()A.元素X与元素Z的最高正化合价之和的数值等于8B.原子半径的大小顺序
Ⅰ. A B C D E F G七种元素 试按下列所给条件推断 ①A B C是同一周期的金属元素 原
Ⅰ A、B、C、D、E、F、G七种元素,试按下列所给条件推断,①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原
(14分)A B C D E F六种短周期元素 其原子序数依次增大 其中B与C同周期 D与E和F同周
(14分)A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外
(12分)【化学——物质结构与性质】(1)过渡金属元素铁能形成多种配合物 如:[Fe(H2NCONH
(12分)【化学——物质结构与性质】(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。①基态Fe3+的M层
随着科学技术的不断进步 研究物质的手段和途径越来越多 N5+ H3 O4 C60等已被发现。 下列有
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。 下列有关说法中,正确的是A.N5+ 离子中含有36个电子B.H2与












