A B C D为原子序数依次增大的前四周期元素 元素A原子最外层电子数比内层多3个 元素B基态原子核
| A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。 ⑴判断离子AB2-离子的空间构型为 。 ⑵元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是 。 ⑶在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 。 ⑷元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。 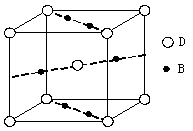 该化合物的化学式为 。 ⑸向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。 ①离子D3+的外围电子排布式为 。 ②1 mol该配合物中含配位键的数目为 。 |
参考解答
| ⑴V形 ⑵两种化合物均为原子晶体,Si—O键键能大于Si—N键 ⑶sp3 ⑷CrO2 ⑸①3d3 ②6NA(每空2分,共12分) |
试题分析:根据信息确定A为氮元素、B为氧元素、C为硅元素、D为铬元素。 ⑴NO2-中心原子形成2个σ键,孤对电子对数= 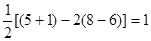 ,故其空间构型为V型或角型。 ,故其空间构型为V型或角型。⑵N、O分别与Si形成的化合物均为原子晶体,由于Si—O键键能大于Si—N键,故O、Si形成的化合物熔点较高。 ⑶在N2H4中,每个氮原子除了形成3个σ键外还有1个孤对电子,故N原子轨道的杂化类型为sp3。 ⑷在该晶胞中含有Cr原子数: 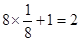 个,含有O原子数: 个,含有O原子数: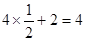 个,则该化合物的化学式为CrO2。 个,则该化合物的化学式为CrO2。⑸①Cr的基态电子排布式为[Ar3d54s1,则Cr3+的外围电子排布式为3d3。 ②该配合物分子中所含配位键数目为3+1+2=6个,则1 mol该配合物中含配位键的数目为6NA。 |
相似问题
(12分)下表为元素周期表的一部分 请参照元素①-⑨在表中的位置 用化学用语回答下列问题: 族周期I
(12分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题: 族周期IA01①ⅡAⅢAⅣAⅤAⅥAⅦA2②③④3⑤⑥⑦⑧⑨(1)在
甲 乙是周期表中同一主族的两种元素 若甲的原子序数为X 则乙的原子序数不可能为 ( )A.X
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能为 ( )A.X+32B.X+4C.X+8D.X+18
(14分)现有A B C D E F G H八种短周期主族元素 原子序数依次增大。已知A与E D与G
(14分)现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电
下列说法不正确的是( ) ①质子数相同的粒子一定是同一种元素 ②质子数相同且电子数也相同的两种粒
下列说法不正确的是( ) ①质子数相同的粒子一定是同一种元素 ②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子 ③电子数相同
(7分)五种短周期元素A B C D E的原子序数依次增大 A和C同族 B和D 同族 C离子和B离子
(7分)五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A












