(14分)现有A B C D E F G H八种短周期主族元素 原子序数依次增大。已知A与E D与G
| (14分)现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题: (1)元素B在周期表中的位置 ,M的空间构型是 。 (2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。 (3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。 (4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式),用离子方程式证明 。 (5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是 (用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。 |
参考解答
| (1)第2周期ⅣA族; 三角锥形 (2) 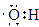 ; ;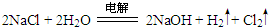 (3)Al(OH)3 + OH-==AlO2- + 2H2O (4)NH3;NH3 + H3O+ ='=' NH4+ + H2O (5)S2-+ H2O  HS- + OH- ;2Na2O2(s) + 2H2O(1)='=4NaOH(aq)' + O2(g) △H=-20Q kJ/mol HS- + OH- ;2Na2O2(s) + 2H2O(1)='=4NaOH(aq)' + O2(g) △H=-20Q kJ/mol |
试题分析:D是地壳中含量最多的元素则为O(氧元素),B的最外层电子数是其电子层数的2倍,则可能为He、C、S,结合原子序数递增,B应为C(碳元素);F位于B的前一主族,则F为Al(铝元素);又D与G同主族,则G为S(硫元素); E、F、G、H同周期,H为Cl(氯元素);A分别与C、D可形成含有10个电子的共价化合物M、N,则A为H(氢元素),C为N(氮元素),M为NH3、N为H2O;A与E同主族,则E为Na。 (1)元素B为碳元素在周期表中位于第2周期ⅣA族,M为NH3,空间构型是三角锥形。 (2)A、D、E三种元素组成一种常见化合物为NaOH,该化合物的阴离子为OH-,与其具有相同的原子种类和数目且不带电的粒子为羟基(—OH),其电子式为 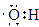 ;工业上利用电解饱和食盐水生成NaOH和氯气,反应的化学方程式为 ;工业上利用电解饱和食盐水生成NaOH和氯气,反应的化学方程式为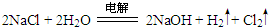 。 。(3)E、F元素的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应的离子方程式为Al(OH)3 + OH-==AlO2- + 2H2O (4)M为NH3、N为H2O,其中NH3更易结合H+,因为可发生反应NH3 + H3O+ ='=' NH4+ + H2O; (5)E分别与D、G形成摩尔质量相等的化合物X、Y分别为Na2O2和Na2S,其中Na2S的水溶液显碱性的原因是硫离子水解,离子方程式为S2-+ H2O  HS- + OH- ;常温下7.8 g Na2O2物质的量为0.1mol,与水反应放出Q kJ热量(Q>0),故该反应的热化学方程式为2Na2O2(s) + 2H2O(1)='4NaOH(aq)' + O2(g) △H=-20Q kJ/mol。 HS- + OH- ;常温下7.8 g Na2O2物质的量为0.1mol,与水反应放出Q kJ热量(Q>0),故该反应的热化学方程式为2Na2O2(s) + 2H2O(1)='4NaOH(aq)' + O2(g) △H=-20Q kJ/mol。 |
相似问题
下列说法不正确的是( ) ①质子数相同的粒子一定是同一种元素 ②质子数相同且电子数也相同的两种粒
下列说法不正确的是( ) ①质子数相同的粒子一定是同一种元素 ②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子 ③电子数相同
(7分)五种短周期元素A B C D E的原子序数依次增大 A和C同族 B和D 同族 C离子和B离子
(7分)五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A
人民网2012年11月8日西宁电 青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )
人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到
(14分) X Y Z W M Q为原子序数依次增大的六种短周期元素 常温下 六种元素的常见单质中三
(14分) X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体。X与M,W与Q分别同主族, X是原
短周期元素A B C原子序数依次递增 它们的原子的最外层电子数之和为10。A与C在周期表中同主族 B
短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确












