【选修3-物质结构与性质】(20分) 19-I(6分)对于钠的卤化物(NaX)和硅的卤化物(SiX4
| 【选修3-物质结构与性质】(20分) 19-I(6分)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是
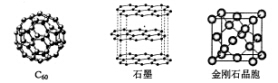 回答下列问题: (1)金刚石、石墨、C60.碳纳米管等都是碳元素的单质形式,它们互为_____________。 (2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为____、____。 (3)C60属于____晶体,石墨属于____晶体。 (4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的____共价键,而石墨层内的C-C间不仅存在____共价键,还有____键。 (5)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(不要求计算结果)。 |
参考解答
19-I B、D ; 19-Ⅱ(1)同素异形体(2)sp3 sp2 (3)分子 混合 (4)σ键 σ键 π键 (或大π键或p-pπ键) (5) 8 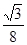 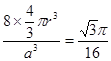 |
试题分析:19-I A. SiX4容易发生水解反应。错误。B. 卤素与硅但是非金属元素,所以二者结合的化合物SiX4是共价化合物。正确。C. NaX是强酸强碱盐,不发生水解反应 。错误。D. NaX是离子化合物,微粒间通过离子键结合,而SiX4则是分子晶体,分子之间通过分子间作用力结合,分子间作用力比化合价弱很多。因此NaX的熔点一般高于SiX4。正确。19-Ⅱ(1) (l)金刚石、石墨、C60、碳纳米管等都是碳元素的单质,性质不同,它们互称同素异形体。(2)在金刚石中碳原子的四个价电子与四个C原子形成四个共价键,C的杂化形式是sp3;在石墨烯(指单层石墨)中碳原子与相邻的三个C原子形成三个共价键,C的杂化形式为sp2;(3) C60是由60个C原子形成的分子,属于分子晶体。而石墨在层内原子间以共价键结合,在层间以分子间作用力结合,所以石墨属于混合晶体;(4)在金刚石中只存在C-C间的σ共价键;在石墨层内的C-C间不仅存在σ共价键,还存在π键。 (5)共价金刚石的立体网状结构金刚石晶胞,属A4型,顶点8个,相当于1个C原子,然后面心上6个,相当于3个C原子,而在其8个四面体空隙中有一半也是C原子,且在晶胞内,故还有4个C原子,加在一起,可得一个金刚石晶胞中有8个C原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则正方体对角线的1/4就是C-C键的键长,即 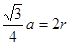 ,所以r= ,所以r=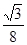 a,碳原子在晶胞中的空间占有率 a,碳原子在晶胞中的空间占有率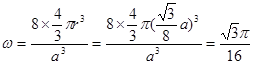 。 。 |
相似问题
下列各组性质比较中 正确的是 ( )①
下列各组性质比较中,正确的是()①酸性:HClO4>HBrO4>HIO4②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2③氧化性:F>C>O④还原性:Cl<S<Si⑤气态氢化物稳定性:HF>
(14分)某配位化合物为深蓝色晶体 由原子序数依次增大的A B C D E五种元素组成 其原子个数比
(14分)某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二
(15分)下表中列出五种短周期元素X Y Z W T的信息。元素相关信息X基态原子最外层电子排布为n
(15分)下表中列出五种短周期元素X、Y、Z、W、T的信息。元素相关信息X基态原子最外层电子排布为nsnnpn+1Y其原子L层电子数是K层3倍Z其单质能与冷水剧烈反
已知原子序数 可推断原子的( )①质子数 ②中子数 ③质量数 ④核电荷
已知原子序数,可推断原子的( )①质子数②中子数③质量数④核电荷数⑤核外电子数⑥原子结构示意图⑦元素在周期表中的位置A.①②③④⑥B.①④⑤⑥⑦C.
下列说法中 正确的是A.第ⅠA族元素都比第ⅡA族元素金属性强B.只含有非金属元素的化合物可能是离子化
下列说法中,正确的是A.第ⅠA族元素都比第ⅡA族元素金属性强B.只含有非金属元素的化合物可能是离子化合物C.只含有共价键的物质一定是共价化合物D.同












