A B C是中学化学中常见的三种元素(A B C代表元素符号)。A位于元素周期表中第4周期 其基态原
| A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号)。A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子。短周期元素B的一种常见单质为淡黄色粉末。元素C的原子最外层电子数是其内层电子数的3倍。 (1)在第3周期中,第一电离能大于B的元素有 种; A与B形成晶体的晶胞如图所示,该晶胞实际拥有Bn-的数目为  (2)B的氢化物(H2B)分子的空间构型为 ;在乙醇中的溶解度:s(H2C)>s(H2B),其原因是 。 (3)B与C可形成BC42- ①BC42-中,B原子轨道的杂化类型是 。 ②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC42-互为等电子体的分子的化学式为 (写出一种即可)。 (4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有 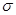 键的物质的量为 mol。 键的物质的量为 mol。 |
参考解答
| (1)(4分)3(2分) 4(2分) (2)(4分)V(折线、角)型(2分) 水分子与乙醇分子之间形成氢键(2分) (3)(2分)①sp3(1分) ②SiCl4或CCl4(1分) (4)(2分)16 |
试题分析:A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子,说明A为Zn元素;短周期元素B的一种常见单质为淡黄色粉末,则B元素为S;元素C的原子最外层电子数是其内层电子数的3倍,说明C为O元素。 (1)在第3周期中,第一电离能大于S的元素有P、Cl、Ar 3种元素;S2 ̄位于晶胞的8个顶点和6个面心,根据切割法可得该晶胞实际拥有S2 ̄为:8×1/8+6×1/2=4。 (2)H2S的结构类似于H2O,为V(折线、角)型;乙醇在H2O中的溶解度大于乙醇在H2O中的溶解度,是因为乙醇分子与H2O分子之间能形成氢键,而乙醇分子与H2S分子之间不能形成氢键。 (3)①SO42 ̄为对称结构,即正四面体型,所以S原子轨道的杂化类型是sp3 ②与SO42 ̄价电子数和原子数分别相同的微粒有SiCl4或CCl4,为等电子体。 (4)A的氯化物与氨水反应可形成配合物[Zn(NH3)4Cl2,12个N—H键为 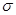 键,4个N原子与Zn形成的配位键也是 键,4个N原子与Zn形成的配位键也是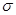 键,所以l mol该配合物中含有 键,所以l mol该配合物中含有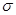 键的物质的量为16mol。 键的物质的量为16mol。 |
相似问题
碳 氢 氟 氮 硅等非金属元素与人类的生产生活息息相关。回答下列问题。(1)写出硅原子的电子排布式_
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关。回答下列问题。(1)写出硅原子的电子排布式________。C、Si、N的电负性由大到小的顺序是______
现有A B C D四种短周期元素 它们的相关结构和性质信息如下表所示 请结合相关信息 完成相关的问题
现有A、B、C、D四种短周期元素,它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:元素相关结构和性质A其单质的一种晶体不是金属晶
有X Y Z三种元素 其中Y Z为短周期元素 X元素在周期表的第五周期 X的负价阴离子的原子核外电子
有X、Y、Z三种元素,其中Y、Z为短周期元素,X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Z和X的原子最外层电
A B C D四种短周期元素 原子序数依次递增 A原子形成的阳离子是一个质子 B原子的最外层电子数是
A、B、C、D四种短周期元素,原子序数依次递增,A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子
原子序数依次增大的X Y Z Q E五种元素中 X元素原子核外有三种不同的能级且各个能级所填充的电子
原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原












