碳 氮 氧是构成生命物质的三种主要元素。(1)碳 氮 氧三种元素中 原子核外电子未成对电子数最多的是
| 碳、氮、氧是构成生命物质的三种主要元素。 (1)碳、氮、氧三种元素中,原子核外电子未成对电子数最多的是________(用元素符号表示)。 (2)已知CN-与N2结构相似,则HCN分子中 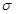 键与 键与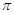 键数目之比为 。 键数目之比为 。(3)H2O2分子中氧原子的杂化方式为___________。 (4)与NO2+互为等电子体的微粒有______、_______(举2例),NO3-的空间构型是_________。 (5)已知元素A的氧化物的晶胞结构如图所示,则该氧化物的化学式为_________。  |
参考解答
| (1)N (2)1:1 (3)sp3 (4)CO2、N2O、CNO-、SCN-等;平面三角形 (5)AO2 |
试题分析:(1)根据核外电子排布规律可知,碳、氮、氧三种元素的核外电子排布分别为1s22s22p2、1s22s22p3、1s22s22p4,因此原子核外电子未成对电子数最多的是N元素。 (2)已知CN-与N2结构相似,因此含有三键,因此HCN分子的结构式为H-C≡N。由于单键都是 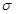 键,而三键是由1个 键,而三键是由1个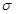 键与2个 键与2个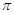 键构成的,所以HCN分子中 键构成的,所以HCN分子中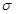 键与 键与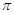 键数目之比为1:1。 键数目之比为1:1。(3)H2O2分子中氧原子分别形成2个单键,另外还有2对孤对电子,所以氧原子的价层电子对数是4,因此氧原子的杂化方式为sp3。 (4)原子数和价电子数分别都相等的互为等电子体,组成NO2+微粒的有3个原子,价电子数是5+6×2-1=16,则与NO2+互为等电子体的微粒有CO2、N2O、CNO-、SCN-等;根据价层电子对互斥理论可知NO3-中含有的孤对电子对数= 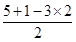 =0,因此价层电子对数是3,所以空间构型是平面三角形。 =0,因此价层电子对数是3,所以空间构型是平面三角形。(5)已知元素A的氧化物的晶胞结构如图所示,则根据均摊法可知晶胞中A原子数=1+8×  =2,O原子数=2+4× =2,O原子数=2+4×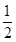 =4,所以该氧化物的化学式为AO2。 =4,所以该氧化物的化学式为AO2。 |
相似问题
A B C D E F G H I是元素周期表前四周期的元素 它们在元素周期中的位置如下图所示:(1
A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:(1)B、C、D三种元素的第一电离能由大到小的顺序为(用元素
元素X的基态原子中的电子共有7个能级 且最外层电子数为1 X原子的内层轨道全部排满电子。在气体分析中
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化
甲 乙 丙 丁为前三周期元素形成的微粒 它们的电子总数相等。已知甲 乙 丙为双原子分子或负二价双原子
甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。(1)丙与钙离子组成的离子
A B C D E F为前四周期元素且原子序数依次增大 其中A含有3个能级 且每个能级所含的电子数相
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素
某氧化剂中 起氧化作用的是X2O72-离子 在溶液中0.2mol该离子恰好能使0.6mol的SO32
某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0 2mol该离子恰好能使0 6mol的SO32-离子完全氧化,则X2O72-离子还原后X的化合价为[ ]A +1 B +2C +3 D +4












