【化学选修-物质结构与性质】(15分)已知前四周期六种元素A B C D E F的原子序数之和为10
| 【化学选修-物质结构与性质】(15分) 已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。 请回答下列问题: ⑴A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号) ⑵化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为________。 ⑶已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN 溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为________________。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。 ⑷EO2与碳酸钡在熔融状态下反应,所得晶体的晶 胞结构如图所示,则该反应的化学方程式为________ 在该晶体中,E4+的氧配为数为____________。若该 晶胞边长为a nm可计算该晶体的密度为__________ g/cm3(阿伏加德罗常数为NA) 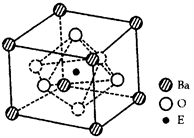 |
参考解答
| (1)Na<P<S<Cl; (2)三角锥型;sp3杂化; (3)3d64s2,N2,2 (4)TiO2+BaCO3= BaTiO2+ CO2↑;6;233/ NAa3×10-21 |
试题分析:D原子得到一个电子后3p轨道全充满,说明D的价电子排布为3s23p5,所以D为Cl元素;E4+离子和氩原子的核外电子排布相同,说明E原子核外有22个电子,所以E是Ti元素;B原子的p轨道半充满,说明B是第VA族元素,该族中氢化物沸点最低的元素是P,所以B是P元素;则C只能是S元素;A与C能形成A2C型离子化和物,所以A是Na元素;A、B、C、D、E、F的原子序数之和为107,所以F是26号元素Fe。 ⑴A、B、C、D是同周期元素,第一电离能随核电荷数的增加而增大,所以A、B、C、D第一电离能由小到大的顺序是Na<P<S<Cl; (2)化合物PCl3中P原子的价层电子对数=3+1/2(5-3×1)=4,有1对孤电子,所以空间构型为三角锥型;P原子是sp3杂化; (3)Fe原子的基态原子的核外电子排布式为[Ar3d64s2,价电子排布为3d64s2,CN-是2原子10个价电子的离子,与之互为等电子体的分子是价电子为5个的N元素的分子N2,则1个CN-中π键数目与1个N2的π键数目相同,都是2个; (4)利用“均摊法”计算晶胞中各原子的个数分别是Ba:1个,O:3个,Ti:1个,所以TiO2与碳酸钡反应生成BaTiO2和二氧化碳,化学方程式为TiO2+BaCO3= BaTiO3+ CO2↑;Ti4+位于4个O原子构成的正方形的中心,即8个O原子构成的正八面体的中心,所以Ti4+的氧配为数为6;晶胞密度=晶胞质量/晶胞体积=(137+69+48)/NA/(a×10-7)3='233/' NAa3×10-21g/cm3 |
相似问题
碳 氮 氧是构成生命物质的三种主要元素。(1)碳 氮 氧三种元素中 原子核外电子未成对电子数最多的是
碳、氮、氧是构成生命物质的三种主要元素。(1)碳、氮、氧三种元素中,原子核外电子未成对电子数最多的是________(用元素符号表示)。(2)已知CN-与N
A B C D E F G H I是元素周期表前四周期的元素 它们在元素周期中的位置如下图所示:(1
A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:(1)B、C、D三种元素的第一电离能由大到小的顺序为(用元素
元素X的基态原子中的电子共有7个能级 且最外层电子数为1 X原子的内层轨道全部排满电子。在气体分析中
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化
甲 乙 丙 丁为前三周期元素形成的微粒 它们的电子总数相等。已知甲 乙 丙为双原子分子或负二价双原子
甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。(1)丙与钙离子组成的离子
A B C D E F为前四周期元素且原子序数依次增大 其中A含有3个能级 且每个能级所含的电子数相
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素












