元素X的基态原子中的电子共有7个能级 且最外层电子数为1 X原子的内层轨道全部排满电子。在气体分析中
| 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下: 2XCl+2CO+2H2O=X2Cl2·2CO·2H2O ⑴X基态原子的电子排布式为 。 ⑵C、H、O三种原子的电负性由大到小的顺序为 。 ⑶X2Cl2·2CO·2H2O是一种配合物,其结构如图所示: 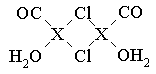 ①与CO为互为等电子体的分子是 。 ②该配合物中氯原子的杂化方式为 。 ③在X2Cl2·2CO·2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键 。 ⑷XCl的晶胞如图所示,距离每个X+最近的Cl—的个数为 。 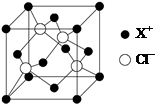 |
参考解答
⑴1s22s22p63s23p63d104s1或[Ar 3d104s1 ⑵O>C>H ⑶①N2 ②sp3 ③ 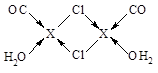 ⑷4 |
试题分析:(1)X电子排布式为1s22s22p63s23p63d104s1,是铜元素;(2)非金属性越强电负性越大,所以为O>C>H;(3)①N2;②根据图示观察,每个氯原子有7个电子与铜的1个电子行成共价键,与另一个铜原子形成配位键,共有4个价电子对,故为sp3杂化;③碳、氧均有孤对电子,形成配位键如上图所示。(4)图示晶胞中不能观察到完成的X成键,但根据Cl原子的成键情况判断X情况,图中观察到每个Cl原子周围有4个X距离最近,因XCl个数比为1:1,故距离每个X+最近的Cl—的个数是4个。 |
相似问题
甲 乙 丙 丁为前三周期元素形成的微粒 它们的电子总数相等。已知甲 乙 丙为双原子分子或负二价双原子
甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。(1)丙与钙离子组成的离子
A B C D E F为前四周期元素且原子序数依次增大 其中A含有3个能级 且每个能级所含的电子数相
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素
某氧化剂中 起氧化作用的是X2O72-离子 在溶液中0.2mol该离子恰好能使0.6mol的SO32
某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0 2mol该离子恰好能使0 6mol的SO32-离子完全氧化,则X2O72-离子还原后X的化合价为[ ]A +1 B +2C +3 D +4
下列各物质的学名是:Na2S2O3叫硫代硫酸钠;CaSx叫多硫化钙;Na2O2叫过氧化钠;KO2叫超
下列各物质的学名是:Na2S2O3叫硫代硫酸钠;CaSx叫多硫化钙;Na2O2叫过氧化钠;KO2叫超氧化钾.试综合上述命名规律,分析回答:Na2CS3应读做A.硫代碳酸
已知X Y和Z三种元素的原子序数之和等于48。X是有机物主要组成元素。X的一种1∶1型气态氢化物分子
已知X、Y和Z三种元素的原子序数之和等于48。X是有机物主要组成元素。X的一种1∶1型气态氢化物分子中既有σ键又有π键。Z是金属元素,Z的核电荷数小于28,且












