从原子 分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索 研究不同类型物质的有关性
从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.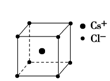 (1)下列说法正确的是 (填字母).
(3)Cu 2+基态的电子排布式为 .向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为 ,不考虑空间构型,其内界结构可用示意图表示为 . |
参考解答
| (1)A ;(2)OCS 平面三角形 (3)1s22s22p63s23p63d9(或[Ar3d9) sp3 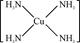 |
| (1)A.同周期自左而右电负性增大,故电负性F>O>N,故A正确; B.苯分子中化学键是介于单键与双键之间的一种特殊化学键,故B错误; C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8,故D错误; D.同周期自左而右等于电离能呈增大趋势,但As原子4p能级有3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se,故D错误; 故选:A; (2)羰基硫(OCS)与CO2为等电子体,具有CO2分子结构,故羰基硫(OCS)结构式为O=C=S, 光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是 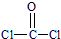 ,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形, ,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,故答案为:O=C=S;平面三角形; (3)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,铜原子失去4s及3d上各一个电子形成Cu2+,故Cu2+离子的电子排布式为:1s22s22p63s23p63d9, NH3分子中N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化; Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,内界结构用示意图表示为 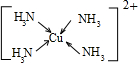 , ,故答案为:1s22s22p63s23p63d9;sp3;  |
相似问题
氯化硼(BN)晶体是一种新型无机合成材料。用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B
氯化硼(BN)晶体是一种新型无机合成材料。用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+ 2CO(NH2)2=4BN+Na2O +4H2O+2CO2↑,根据要求回答下列问
短周期中的三种元素X Y Z 原子序数依次减小 原子核外电子层数之和是5 X元素原子的最外层电子数是
短周期中的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5,X元素原子的最外层电子数是Y和Z两元素原子的最外层电子数的总和;Y元素原子的
下列说法正确的是A.原子最外层电子数为2的元素一定处于周期表的第IIA族B.构成单质的分子中一定含有
下列说法正确的是A.原子最外层电子数为2的元素一定处于周期表的第IIA族B.构成单质的分子中一定含有共价键C.同主族元素形成的氧化物的晶体类型均相同D
钛和钛的合金已被广泛用于制造电讯器材 人造骨骼 化工设备 飞机等航天航空材料 被誉为“未来世界的金属
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:(1)钛有两种原子,它们
用Cr3+掺杂的氮化铝是理想的LED用荧光粉基质材料 氮化铝(其晶胞如图所示)可由氯化铝与氨经气相反
用Cr3+掺杂的氮化铝是理想的LED用荧光粉基质材料,氮化铝(其晶胞如图所示)可由氯化铝与氨经气相反应制得。(1)Cr3+基态的核外电子排布式可表示为。(2












