(8分)汽车尾气主要含有CO2 CO SO2 NO及汽油 柴油等物质 这种尾气越来越成为城市空气污染
| (8分)汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等物质,这种尾气越来越成为城市空气污染的主要来源,必须予以治理。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使汽油、柴油等物质充分燃烧及SO2的转化。 (1)汽车尾气中NO的来源是 。 A.汽油、柴油中含氮,是其燃烧产物 B.是空气中的N2与汽油、柴油的反应产物 C.是空气中的N2与O2在汽车气缸内的高温环境下的反应产物 D.是汽车高温尾气导致了空气中N2与O2的化合反应 (2)写出CO与NO反应的化学方程式: 。 (3)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是 (4)控制或者减少城市汽车尾气污染的方法可以有 。(多选) A.开发氢能源 B.使用电动车 C.限制车辆行驶 D.使用乙醇汽油 |
参考解答
(8分)(1)C ;(2) 2CO+2NO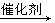 2CO2+N2 ; 2CO2+N2 ; (3) SO2转化为SO3,产生了硫酸酸雾 ; (4) ABD |
| 略 |
相似问题
(14分)氮可形成多种氧化物 如NO NO2 N2O4等 NO2和N2O4可以相互转化。(1)对反应
(14分)氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化。(1)对反应2NO2(g)N2O4(g)△H=-57 2kJ·mol-1①在温度为T1、 T2时,平衡
一定条件下 在体积为10 L的恒容密闭容器中 发生如下反应:2X(s)+Y(g)Z(g) 经60 s
一定条件下,在体积为10 L的恒容密闭容器中,发生如下反应:2X(s)+Y(g)Z(g),经60 s达到平衡,生成0 3 mol Z,下列说法正确的是()A.用X 表示的
在甲 乙两个容积均为1L的密闭容器中 保持两容器的温度相同 进行如下反应:2A(g)+B(g)pC(
在甲、乙两个容积均为1L的密闭容器中,保持两容器的温度相同,进行如下反应:2A(g)+B(g)pC(g),①向甲中通入3molA和1 5molB,达到平衡时测得其中C的体积
已知:N2(g)+3H2(g) 2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两
已知:N2(g)+3H2(g) 2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达
下图表示可逆反应mA(g)+nB(g) pC(g)在不同温度(T) 压强(P)下 生成物C的质量分数
下图表示可逆反应mA(g)+nB(g) pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数












