海水是巨大的资源宝库 从海水中提取食盐和溴的过程如下:(1)步骤Ⅰ中已获得Br2 步骤Ⅱ中又将Br2
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下: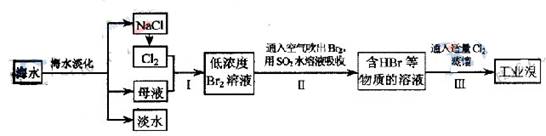 (1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br ̄,其目的为 。 (2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。 (3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图: 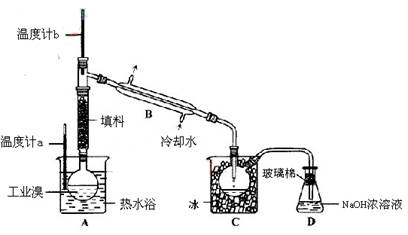 请你参与分析讨论: ①图中仪器B的名称 。 ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。 ③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。 ④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。 |
参考解答
| (1)富集溴元素 (2)Br2+SO2+2H2O=4H++SO42-+2Br- 强酸对设备的严重腐蚀 (3)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度,并收集59℃时的馏分 ④深红棕色 分液(或蒸馏) |
试题分析:(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴,所以目的是用于富集溴元素。 (2)二氧化硫被溴单质氧化,所以离子方程式为:Br2+SO2+2H2O═4H++SO42-+2Br-,工业生产中应解决的主要问题是反应生成了两种强酸,易腐蚀设备。 (3)①图中仪器B为冷凝管。 ②溴具有腐蚀性,可以腐蚀橡胶。 ③蒸馏的目的,就是通过沸点不同而提纯Br2,根据Br2的沸点为59℃,所以要通过温度计b测量气体的温度,收集59℃时的馏分。 ④C中收集的为液溴,颜色为深红棕色;利用Cl2与Br2溶解性的不同,可用分液法分离,利用Cl2与Br2沸点不同,可用蒸馏法分离。 |
相似问题
用于分离或提纯物质的方法有:A蒸馏(分馏);B萃取;C过滤;D重结晶;E分液。下列各组混合物的分离或
用于分离或提纯物质的方法有:A蒸馏(分馏);B萃取;C过滤;D重结晶;E分液。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)(
除去下列物质中所含少量杂质 填写所选用的试剂和分离方法 混合物(括号内为少量杂质)试剂(足量)分离方
除去下列物质中所含少量杂质,填写所选用的试剂和分离方法混合物(括号内为少量杂质)试剂(足量)分离方法A苯(苯酚)B乙烯(SO2)C乙酸乙酯(乙酸)D乙醇(水)
下列四组物质 均可用一种试剂进行鉴别的是①黑色固体:FeO Fe(粉) CuO C②无色溶液:(N
下列四组物质,均可用一种试剂进行鉴别的是①黑色固体:FeO、Fe(粉)、CuO、C②无色溶液:(NH4) 2SO4、NH4Cl、Na2SO4、NaCl③无色溶液:乙醛、乙酸、
某小组设计如图装置(部分夹持装置已略去) 以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。(
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。(1)试剂X的化学式。A中制取Cl2的离子方程式。(2)试剂Y
下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法 正确的一组是 物质杂质除杂试剂或操作方
下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的一组是物质杂质除杂试剂或操作方法①酒精水蒸馏②H2CO2通过盛有NaOH溶液洗气瓶,












