一瓶氢氧化钠固体 因不慎敞口放置了一段时间 已经部分变质。化学课外兴趣小组的同学决定测定该瓶试剂变质
| 一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作: 知识回顾:氢氧化钠必须密封保存;氢氧化钠与二氧化碳反应生成Na2CO3和H2O;CaCO3不溶于水。 第一步:取该瓶中的试剂20g加水配制成溶液; 第二步:向上述溶液中加入足量的澄清石灰水; 第三步:过滤、干燥、称量,生成沉淀为5g。 ⑴若该瓶试剂中的Na2CO3的质量分数为A,则氢氧化钠的质量分数___________(填大于、等于或小于)A,原因是__________________。 ⑵计算该20g试剂中含有杂质Na2CO3的质量分数(结果精确到0.1%)。 |
参考解答
| ⑴小于;试剂中含有水 ⑵解:设该20g试剂中含碳酸钠的质量为x。 Na2CO3+Ca(OH)2==CaCO3↓+2NaOH 106 100 x 5g 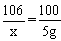 x=5.3g 该20g试剂中含碳酸钠的质量分数为: 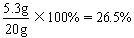 |
相似问题
12.5g不纯的碳酸钙与足量的盐酸反应 生成4.4g二氧化碳 这种碳酸钙的纯度是(杂质不与盐酸反 应
12 5g不纯的碳酸钙与足量的盐酸反应,生成4 4g二氧化碳,这种碳酸钙的纯度是(杂质不与盐酸反 应)[ ]A.80%B.75%C.100%D.90%
实验室用6.5g锌与100g稀硫酸反应 当恰好完全反应时 求:(1)可制得氢气的质量是多少?(2)该
实验室用6 5g锌与100g稀硫酸反应,当恰好完全反应时,求:(1)可制得氢气的质量是多少?(2)该硫酸溶液的溶质质量分数。
现有铜与另一种金属的混合物粉末 另一种金属可能是镁 铁 锌中的一种 现欲测定其组成。【实验步骤及数据
现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成。【实验步骤及数据】取该混合物粉末8 0 g放入烧杯中,将140 0g1
硝酸铵是农业生产中常用的化学肥料。为测定某含有少量杂质的硝酸铵样品中NH4NO3的纯度(杂质不与碱反
硝酸铵是农业生产中常用的化学肥料。为测定某含有少量杂质的硝酸铵样品中NH4NO3的纯度(杂质不与碱反应),取20g该硝酸铵样品于容器中,不断滴入NaOH溶液
一批铸造好的铜锌合金硬币 为了检测其中铜的含量 取30克稀硫酸放在烧杯中然后取合金样品10克 放入硫
一批铸造好的铜锌合金硬币,为了检测其中铜的含量,取30克稀硫酸放在烧杯中然后取合金样品10克,放入硫酸中在计量器上测出烧杯中的物质量变化如下表:(1












