实验室用6.5g锌与100g稀硫酸反应 当恰好完全反应时 求:(1)可制得氢气的质量是多少?(2)该
| 实验室用6.5g锌与100g稀硫酸反应,当恰好完全反应时,求: (1)可制得氢气的质量是多少?(2)该硫酸溶液的溶质质量分数。 |
参考解答
| 解:设可制的氢气的质量为X,需要硫酸的质量为Y (1)由题意可知锌完全反应 Zn + H2SO4==ZnSO4 + H2↑ 65 98 2 6.5g Y X 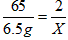 X=0.2g X=0.2g(2)需要硫酸的质量: 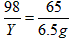 Y=9.8g Y=9.8g硫酸溶液的质量分数 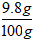 ×100%=9.8% ×100%=9.8% 答:制取氢气的质量为0.2克;硫酸溶液的质量分数为9.8%。 |
相似问题
现有铜与另一种金属的混合物粉末 另一种金属可能是镁 铁 锌中的一种 现欲测定其组成。【实验步骤及数据
现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成。【实验步骤及数据】取该混合物粉末8 0 g放入烧杯中,将140 0g1
硝酸铵是农业生产中常用的化学肥料。为测定某含有少量杂质的硝酸铵样品中NH4NO3的纯度(杂质不与碱反
硝酸铵是农业生产中常用的化学肥料。为测定某含有少量杂质的硝酸铵样品中NH4NO3的纯度(杂质不与碱反应),取20g该硝酸铵样品于容器中,不断滴入NaOH溶液
一批铸造好的铜锌合金硬币 为了检测其中铜的含量 取30克稀硫酸放在烧杯中然后取合金样品10克 放入硫
一批铸造好的铜锌合金硬币,为了检测其中铜的含量,取30克稀硫酸放在烧杯中然后取合金样品10克,放入硫酸中在计量器上测出烧杯中的物质量变化如下表:(1
2010年6月2日23时53分 第四颗北斗导航卫星在我国西昌卫星发射中心成功发射。发射卫星的火箭用联
2010年6月2日23时53分,第四颗北斗导航卫星在我国西昌卫星发射中心成功发射。发射卫星的火箭用联氨(N2H4)作燃料,用四氧化二氮(N2O4)作助燃剂,反应
继黄金 白金之后 钯金(Pd)首饰在市场上悄然兴起。为了获得钯金 取17.7%的PdCl2溶液100
继黄金、白金之后,钯金(Pd)首饰在市场上悄然兴起。为了获得钯金,取17 7%的PdCl2溶液100g,加入10 0g铁粉使其充分反应得到钯金和铁的氯化物。经分析所












