钛冶炼厂与氯碱厂 甲醇厂组成一个产业链(如图所示) 将大大提高资源的利用率 减少环境污染。请回答下列
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。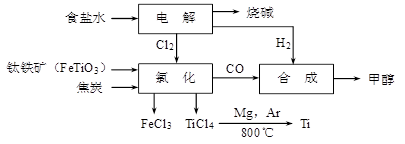 请回答下列问题: (1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图_______。 (2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。 (3)氯碱厂获得Cl2的离子方程式为
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。 (5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。 |
参考解答
(1) (2)2FeTiO3+6C+7Cl2高温2FeCl3+2TiCl4+6CO (2分) (3)2Cl- + 2H2O  H2↑ + Cl2↑ + 2OH-(2分) H2↑ + Cl2↑ + 2OH-(2分)(4)1412 (2分) (5)7:1 |
试题分析:(1)铁位于元素周期表的第4周期第Ⅷ族,是过渡金属元素的代表,原子序数为26,电子层结构为: 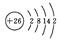 (2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为FeTiO3+6C+7Cl2高温2FeCl3+2TiCl4+6CO; (3)工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。阳极反应:2Cl--2e-=Cl2↑(氧化反应);阴极反应:2H++2e-=H2↑(还原反应);因此,电解饱和食盐水的总反应可以表示为:2Cl- + 2H2O  H2↑ + Cl2↑ + 2OH-; H2↑ + Cl2↑ + 2OH-;(4)Ar气中进行防止钛、镁被氧化;控制温度使TiCl4、Mg、MgCl2转化为蒸气,Ti不熔化,故温度略高于1412℃; (5)根据2Cl- + 2H2O  H2↑ + Cl2↑ + 2OH-;再根据图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+ H2↑ + Cl2↑ + 2OH-;再根据图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+ 2FeCl3+2TiCl4+6CO,得出关系式2FeTiO3 ~ 7Cl2 ~ 14NaCl,所以为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为7:1时,理论上Cl2的利用率最大。 2FeCl3+2TiCl4+6CO,得出关系式2FeTiO3 ~ 7Cl2 ~ 14NaCl,所以为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为7:1时,理论上Cl2的利用率最大。 |
相似问题
已知A2On2-可将B2-氧化为B单质 A2On2-则被还原为A3+ 又知100mL的0.3mol/
已知A2On2-可将B2-氧化为B单质,A2On2-则被还原为A3+,又知100mL的0 3mol L的A2On2-与150mL的0 6mol L B2-恰好完全反应,则A2On2-中的n值为 [ ]A.4 B.5 C.6D.7
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中 恰好完全反应 则还原
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是()A.MB.M2+C.M3+D.MO2+
氧化还原反应综合应用:氧化还原反应滴定(1)配平氧化还原反应方程式:C2O42-+ MnO4-+
氧化还原反应综合应用:氧化还原反应滴定(1)配平氧化还原反应方程式:C2O42-+MnO4-+H+=CO2↑+Mn2++H2O(2)称取6 0 g含H2C2O4·2H2O、KHC2O4和K2S
下列叙述正确的是①7Li+中含有的中子数与电子数之比为2︰1② 在C2H6分子中极性共价键与非极性共
下列叙述正确的是①7Li+中含有的中子数与电子数之比为2︰1② 在C2H6分子中极性共价键与非极性共价键数之比为3︰1③ 常温下,11.2 L的甲烷气体中含有
把7.2 g铁粉投入某硝酸溶液中 充分反应剩余固体1.6 g 产生NO2和NO的混合气体0.08 m
把7 2 g铁粉投入某硝酸溶液中,充分反应剩余固体1 6 g,产生NO2和NO的混合气体0 08 mol。若不考虑N2O4的存在,则原HNO3溶液中HNO3的物质的量为( )A.












