把7.2 g铁粉投入某硝酸溶液中 充分反应剩余固体1.6 g 产生NO2和NO的混合气体0.08 m
把7.2 g铁粉投入某硝酸溶液中,充分反应剩余固体1.6 g,产生NO2和NO的混合气体0.08 mol。若不考虑N2O4的存在,则原HNO3溶液中HNO3的物质的量为( )
|
参考解答
| C |
因为有铁粉剩余则生成的盐为Fe(NO3)2,且HNO3已反应完。参与反应的n(Fe)=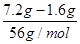 =0.1 mol,n[Fe(NO3)2=n(Fe)=0.1 mol,则原溶液中n(HNO3)=2n[Fe(NO3)2+[n(NO2)+n(NO)=2×0.1 mol+0.08 mol=0.28 mol。 =0.1 mol,n[Fe(NO3)2=n(Fe)=0.1 mol,则原溶液中n(HNO3)=2n[Fe(NO3)2+[n(NO2)+n(NO)=2×0.1 mol+0.08 mol=0.28 mol。 |
相似问题
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉 假设加入铁粉的质量与产生气体的体积(标
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列
人体正常的血红蛋白中含有亚铁离子 若误食亚硝酸盐 则使血红蛋白中亚铁离子转化为铁离子而丧失其生理功能
人体正常的血红蛋白中含有亚铁离子,若误食亚硝酸盐,则使血红蛋白中亚铁离子转化为铁离子而丧失其生理功能,临床证明服用维生素C可以解毒,这说明维生素
某金属元素由氧化物转变为单质 则该金属元素( )A.一定被氧化B.一定被还原C.可能被氧化 也可能
某金属元素由氧化物转变为单质,则该金属元素( )A.一定被氧化B.一定被还原C.可能被氧化,也可能被还原D.既不被氧化,也不被还原
亚硝酸钠是一种防腐剂和增色剂 但在食品中过量时会对人体产生危害。其在酸性条件下会产生NO和NO2。下
亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害。其在酸性条件下会产生NO和NO2。下列有关说法错误的是( )A.NaNO2既具有氧化性又具
有一未完成的离子方程式:□□+ XO3-+6H+═3X2+3H2O 据此判断X元素的最高化合价为A.
有一未完成的离子方程式:□□+ XO3-+6H+═3X2+3H2O,据此判断X元素的最高化合价为A.+7B.+6C.+5D.+1












