氧化还原反应综合应用:氧化还原反应滴定(1)配平氧化还原反应方程式:C2O42-+ MnO4-+
| 氧化还原反应综合应用:氧化还原反应滴定 (1)配平氧化还原反应方程式: C2O42-+ MnO4-+ H+= CO2↑+ Mn2++ H2O (2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。 ①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为 mol。 ②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。 A.KMnO4溶液在滴定过程中作 (填“氧化剂”或“还原剂”),该滴定过程 (填“需要”或“不需要”)另加指示剂。滴至16 mL时反应完全,此时溶液颜色由 变为 。 B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果 (填“偏大”、“偏小”或“无影响”)。 C.若在达到滴定终点时俯视读数,则所得结果 (填“偏大”、“偏小”或“无影响”)。 ③原试样中H2C2O4·2H2O的质量分数为 ,KHC2O4的质量分数为 。 |
参考解答
| (1)5 2 16 10 2 8 (2)①0.005 ②A.氧化剂 不需要 无色 浅紫红色 B.无影响 C.偏小 ③21% 64% |
| (1)C:+3―→+4,改变量(4-3)×2=2,Mn:+7―→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,再由电荷守恒在H+前配16,最后根据离子方程式两边的H原子个数相等在水前面配8,经检验离子方程式的氧原子个数相等。 (2)①由H++OH-=H2O知,n(H+)=n(OH-)=0.25 mol·L-1×0.02 L=0.005 mol。②原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈浅紫红色。由得失电子守恒得,n(还)×2=0.10 mol·L-1×0.016 L×5,n(还)=0.004 mol。③设6.0 g试样中H2C2O4·2H2O、KHC2O4的物质的量分别为n(H2C2O4·2H2O)、n(KHC2O4),由①得:2n(H2C2O4·2H2O)+n(KHC2O4)=0.05 mol,由②得:n(H2C2O4·2H2O)+n(KHC2O4)=0.04 mol,解上述两个方程式得:n(H2C2O4·2H2O)=0.01 mol,n(KHC2O4)=0.03 mol,H2C2O4·2H2O的质量分数为 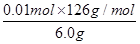 ×100%=21%,KHC2O4的质量分数为 ×100%=21%,KHC2O4的质量分数为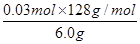 ×100%=64%。 ×100%=64%。 |
相似问题
下列叙述正确的是①7Li+中含有的中子数与电子数之比为2︰1② 在C2H6分子中极性共价键与非极性共
下列叙述正确的是①7Li+中含有的中子数与电子数之比为2︰1② 在C2H6分子中极性共价键与非极性共价键数之比为3︰1③ 常温下,11.2 L的甲烷气体中含有
把7.2 g铁粉投入某硝酸溶液中 充分反应剩余固体1.6 g 产生NO2和NO的混合气体0.08 m
把7 2 g铁粉投入某硝酸溶液中,充分反应剩余固体1 6 g,产生NO2和NO的混合气体0 08 mol。若不考虑N2O4的存在,则原HNO3溶液中HNO3的物质的量为( )A.
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉 假设加入铁粉的质量与产生气体的体积(标
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列
人体正常的血红蛋白中含有亚铁离子 若误食亚硝酸盐 则使血红蛋白中亚铁离子转化为铁离子而丧失其生理功能
人体正常的血红蛋白中含有亚铁离子,若误食亚硝酸盐,则使血红蛋白中亚铁离子转化为铁离子而丧失其生理功能,临床证明服用维生素C可以解毒,这说明维生素
某金属元素由氧化物转变为单质 则该金属元素( )A.一定被氧化B.一定被还原C.可能被氧化 也可能
某金属元素由氧化物转变为单质,则该金属元素( )A.一定被氧化B.一定被还原C.可能被氧化,也可能被还原D.既不被氧化,也不被还原












