CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KaCub(C2O4)c·nH2O。通过下
| CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KaCub(C2O4)c·nH2O。通过下述实验确定该晶体的组成。 步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.2000mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑ 步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为:I2+2S2O32-=2I-+S4O62- (1)步骤b中生成白色沉淀的离子方程式: 。 (2)步骤b中“将溶液充分加热”的目的是 。 (3)请完成下列确定样品组成的计算过程。 ①计算样品中n (C2O42-)(写出计算过程) ②计算样品中n (Cu2+) (写出计算过程) ③根据 原理可求出n (K+),再依据 原理求得n (H2O) ④该样品晶体的化学式为 |
参考解答
| (1)2Cu2++4I-=2CuI↓+I2 (2)除去微量的MnO4-,以免影响实验结果的测定 (3)① 2MnO4- ~ 5C2O42- ② 2S2O32- ~ I2 ~ 2Cu2+ 2 5 2 2 0.2×8×10-3mol 4×10-3mol 0.25×8×10-3mol 2×10-3mol n (C2O42-)= 4×10-3mol n (Cu2+)= 2×10-3mol ③电荷守恒 质量守恒 ④K2Cu(C2O4)2·H2O |
试题分析:(1)由Cu2+→ 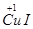 ~e-,2I-→I2~2e-,结合原子守恒和电荷守恒配平。 ~e-,2I-→I2~2e-,结合原子守恒和电荷守恒配平。(2)MnO4-与C2O42-发生氧化还原反应,加热可使二者反应充分,防止MnO4-对后面的实验干扰。 (3)①由关系式2MnO4- ~ 5C2O42-,n (C2O42-)= 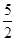 n (MnO4-)= 0.2×8×10-3mol= 4×10-3mol; n (MnO4-)= 0.2×8×10-3mol= 4×10-3mol;②由关系式2S2O32- ~ I2 ~ 2Cu2+,n (Cu2+)= n (S2O32-)= 0.25×8×10-3mol = 2×10-3mol ③电荷守恒式:n(K+)+2n(Cu2+)=2n( C2O42-),将n (Cu2+)= 2×10-3mol,n (C2O42-)= 4×10-3mol带入,解得n(K+)=4×10-3mol;m(H2O)=m(样品)-m (K+)- m(Cu2+)-m( C2O42-)。 ④m(H2O)='0.' 6720g-4×10-3mol×39g?mol-1-2×10-3mol×64g?mol-1-4×10-3mol×88 g?mol-1=0.036g n(H2O)='0.036' g/(18 g?mol-1)='0.' 002 mol,即n(K+): n(Cu2+): n( C2O42-):n(H2O)=2:1:2:1,即化学式为K2Cu(C2O4)2·H2O。 |
相似问题
(1)(11分)在氧化还原反应中 氧化剂______电子 发生的反应是_________反应;还原剂
(1)(11分)在氧化还原反应中,氧化剂______电子,发生的反应是_________反应;还原剂________电子,发生的反应是____________反应。铁与氯气反应的方
(6分)根据反应8NH3 + 3Cl2 ='=' 6NH4Cl + N2 回答下列问题:(1) 还
(6分)根据反应8NH3 + 3Cl2 ="=" 6NH4Cl + N2 ,回答下列问题:(1) 还原剂是(写化学式);(2) 用双线桥法表示该反应电子转移的方向和数目;(3
肼(N2H4)是火箭发射常用的燃料。(1)最新实验研究用肼还原新制Cu(OH)2可制备纳米级Cu2O
肼(N2H4)是火箭发射常用的燃料。(1)最新实验研究用肼还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。请写出该制法的化学反应方程式___________________
对反应3Cl2 + 8NH3== 6 NH4Cl + N 2(1)该反应中的氧化剂是____
对反应3Cl2 + 8NH3== 6 NH4Cl + N 2(1)该反应中的氧化剂是__________ ,被氧化的元素是。(2) 1 mol Cl2参加反应,被氧化的NH3的物质的量
在一定条件下 RO3n-和Cl2可发生如下反应:RO3n-+Cl2+ H2O=RO42-+2Cl-+
在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+ H2O=RO42-+2Cl-+2H+,从而可知在RO3n-中,元素R的化合价是A.+4价B.+5价C.+6价D.+7价












