铜及其化合物在工农业生产及日常生活中应用非常广泛。(1)由辉铜矿制取铜的反应过程为: 2Cu2S(s
| 铜及其化合物在工农业生产及日常生活中应用非常广泛。 (1)由辉铜矿制取铜的反应过程为: 2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1,① 2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g) △H=+116.0kJ·mol-1,② ①热化学方程式:Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H= kJ·mol-1。 ②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。 (2)氢化亚铜是一种红色固体,可由下列反应制备 4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4 。 ①该反应还原剂是 (写化学式)。 ②该反应每转移3 mol电子,生成CuH的物质的量为 。 (3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。 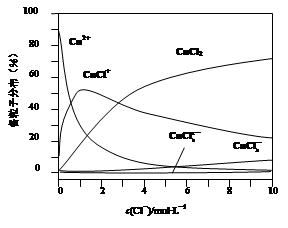 ①当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。 ②在c(Cl-)="1" mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。 (4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过) ①阳极的电极反应式为____________________。 ②产品室中反应的离子方程式为____________。 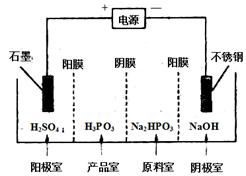 |
参考解答
| (16分)(1)①Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=-217.4KJ/mol;(2分) ②阳;(2分) (2)①H3PO2(2分);②1mol(2分); (3)①c(CuCl2)>c(CuCl+)>c(CuCl3-)(2分); ②Cu2++Cl-═CuCl+(2分). (4)①4OH--4e-=2H2O+O2↑(2分) ②HPO32-+2H+=H3PO3(2分) |
试题分析:(1)①根据盖斯定律可得Cu2S(s) + O2(g) =' 2Cu(s)' + SO2(g) △H=(①+②)/3=(-768.2kJ·mol-1+116.0kJ·mol-1)/3=-217.4KJ/mol; ②粗铜精炼时,粗铜作阳极,纯铜作阴极; (2)①根据还原剂的判断,元素化合价升高的物质作还原剂,在4CuSO4 + 3H3PO2 + 6H2O =' 4CuH↓' + 4H2SO4 + 3H3PO4 中P元素的化合价升高,所以还原剂是H3PO2; ②该反应中每生成4molCuH转移 12mol电子,所以每转移3 mol电子,生成CuH的物质的量为1mol; (3)①由图可知,当c(Cl-)='9' mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-); ②从图上可见,在c(Cl-)=1mol?L-1的氯化铜溶液中,主要是Cu2+与Cl-结合生成CuCl+,方程式为:Cu2++Cl-═CuCl+; (4)①根据离子的放电顺序及溶液中离子的种类,在阳极放电的是氢氧根离子,所以阳极电极反应式为4OH--4e-=2H2O+O2↑; ②产品室中有亚磷酸生成,原料室中的磷酸氢根离子通过阴膜到达产品室,与通过阳膜到达产品室的氢离子结合生成亚磷酸,所以产品室中的离子方程式为HPO32-+2H+=H3PO3。 |
相似问题
一定量的CuS和Cu2S的混合物投入足量的HNO3中 收集到气体a mol 向反应后的溶液中(存在C
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,
(6分)在50mL a mol·L-1的硝酸溶液中 加入6.4g Cu 全部溶解 假设硝酸的还原产物
(6分)在50mL a mol·L-1的硝酸溶液中,加入6 4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)="3"
对于反应4FeS2+11O2 高温 . 2Fe2O3+8SO2 下列叙述正确的是( )A.铁和硫
对于反应4FeS2+11O2高温 2Fe2O3+8SO2,下列叙述正确的是( )A.铁和硫两种元素被还原B.只有硫元素被氧化C.转移电子总数是44e-D.Fe2O3为氧化产物,SO2为还原产物
分类法在化学学科的发展中起到了非常重要的作用 下列分类标准合理的是( )A.根据是否具有丁达尔效应
分类法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是( )A.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体B.根据反应中
现有含0.1 mol/L的SO32-溶液30 mL 恰好被2×10-3 mol XO4-氧化为SO4
现有含0.1 mol L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是A.+4 B.+3 C.+2 D.+1












