(每空2分 共12分)仔细阅读下列三段文字①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物X
| (每空2分,共12分)仔细阅读下列三段文字 ①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。 ②将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2; 向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。 ③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: Cl2+2e- =2Cl- 回答问题: (1)试写出①有关的离子方程式:_________ _______。 (2)请配平②的化学方程式: KMnO4+ HCl - KCl+ MnCl2+ Cl2↑+ H2O 通过对第②段文字中提供的数据进行推导和计算可得出: a +b的最大值为 ,a +b最小值为 。 (3)下列四种物质中能使③中的还原过程发生的物质是 。
 |
参考解答
| (每空2分,共12分)(1)5XeO3+6Mn2++9H2O====5Xe+6MnO4-+18H+。 (2)配平 2 、 16 =' 2' 、2 、 5 、 8 , 0.2 , 0.16 。 (3) D 。 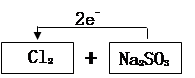 |
| (1)溶液逐渐变为紫红色且pH不断减小,所以反应中有MnO4-和H+生成,因此反应的方程式是5XeO3+6Mn2++9H2O====5Xe+6MnO4-+18H+。 (2)根据方程式可知,锰元素的化合价从+7价降低到+2价,得到5个电子。氯元素的化合价从-1价升高到0价,失去1个电子,所以根据电子的得失守恒和质量守恒可知,配平后的计量数分别是 2 、 16 =' 2' 、2 、 5 、 8;氧气是amol,氯气是bmol,所以根据电子的得失守恒可知,4a+2b=0.08×5,即a+b=0.2-a,由于a的最大值是0.04,最小值是0,所以a+b的最大值是0.2mol,最小值是0.16mol。 (3)碳酸钠没有还原性,现象B和C都具有强氧化性,能氧化氯离子,亚硫酸钠具有还原性,所以答案选D。 |
相似问题
(6分)实验室常用浓盐酸与二氧化锰反应来制取少量的氯气 反应的化学方程式为:MnO2+4HCl(浓)
(6分)实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。(1)写出该反应的离子方程式_________
氧化还原反应在生产 生活中具有广泛的用途 贯穿古今。(1)下列生产 生活中的事例中发生了氧化还原反应
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。(1)下列生产、生活中的事例中发生了氧化还原反应的是( )(2)水是人体的重要组成部分,是人
一定条件下自然界存在如下反应:14CuSO4+5FeS2+l2H2O==7Cu2S+5FeSO4+1
一定条件下自然界存在如下反应:14CuSO4+5FeS2+l2H2O==7Cu2S+5FeSO4+12H2SO4,下列说法中不正确的是 ()A.CuSO4和FeS2是氧化剂,FeS2是还原剂B.5 mol
(14分)实验室中所用少量氯气是用下列方法制取的 4HCl(浓)+MnO2Cl2↑+MnCl2+2H
(14分)实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O试回答下列问题:(1)该反应是氧化还原反应吗?,如果是氧化还原
火药是中国的“四大发明”之一 永远值得炎黄子孙骄傲 也永远会激励着我们去奋发图强。黑火药在发生爆炸时
火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+C












