(1)合成氨反应N2(g)+3H2(g)2NH3(g) 若在恒温 恒压条件下向平衡体系中通入1mol
(1)合成氨反应N2(g)+3H2(g)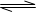 2NH3(g),若在恒温、恒压条件下向平衡体系中通入1mol N2和3mol H2,平衡后NH3的体积分数为a;若在恒温、恒容条件下向平衡体系中通入lmol N2和3mol H2,平衡后NH3的体积分数为b,则a b(填“大于”、“等于”、“小于”)。 2NH3(g),若在恒温、恒压条件下向平衡体系中通入1mol N2和3mol H2,平衡后NH3的体积分数为a;若在恒温、恒容条件下向平衡体系中通入lmol N2和3mol H2,平衡后NH3的体积分数为b,则a b(填“大于”、“等于”、“小于”)。(2)有一带有刻度的容器被一种特殊的隔膜分成左右两部分,如下图所示: 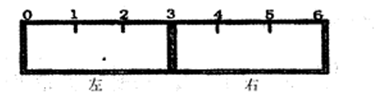 若该隔膜为阳离子交换膜(只允许阳离子自由通过),且将该膜固定在3处,左边充满滴有少量KSCN溶液的FeCl2溶液,右边充满酸性KMnO4溶液,一段时间后可观察到的现象:左 ,右 。(从下列选项中选择)
|
参考解答
| (1)大于(2分)(2)A(2分) C(2分) 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分) |
| (1)反应向正向进行,恒温、恒压条件下,平衡时体积比原来要小,此时NH3的体积分数为a;若在恒温、恒容条件下,相当于在恒压条件下进行减压操作,减压平衡向逆向移动,平衡后NH3的体积分数要变小,b小于a。 (2)阳离子交换膜,只许亚铁离子透过半透膜,从左进入右端,同时发生Fe2+和MnO4-离子间的氧化还原反应,亚铁离子被氧化为三价铁离子,高锰酸根被还原为二价锰离子。左边溶液颜色几乎没影响,右端溶液颜色变浅。 点评:考察等效平衡,氧化还原反应等相关知识。 |
相似问题
(4分)将固体NH4I置于密闭容器中 某温度下发生下列变化:NH4I(s) NH3 (g) + H
(4分)将固体NH4I置于密闭容器中,某温度下发生下列变化:NH4I(s) NH3 (g) + HI(g) 2HI(g) H2(g) + I2(g)当反应达到平衡时c (H2)=" 0 5" mol
(6分)在80℃时 将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应
(6分)在80℃时,将0 40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应N2O4(g)2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容
二甲醚是一种重要的清洁燃料 也可替代氟利昂作制冷剂等 对臭氧层无破坏作用。工业上利用煤的汽化产物(水
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上利用煤的汽化产物(水煤气)合成二甲醚。请回答下列问题:(1)煤的
一定温度下 在密闭容器中 发生反应: 2NO22NO+O2 经过一定时间后 测得混合气中NO2浓度为
一定温度下,在密闭容器中,发生反应: 2NO22NO+O2,经过一定时间后,测得混合气中NO2浓度为0 06 mol·L-1, O2的浓度为0 12 mol·L-1,且各物
X Y Z三种气体 取X和Y按2∶1的物质的量之比混合 放入固定体积的密闭容器中发生如下反应:X +
X、Y、Z三种气体,取X和Y按2∶1的物质的量之比混合,放入固定体积的密闭容器中发生如下反应:X + 2Y2Z ,达到平衡后, X的转化率不可能为A.25%B.20%C.15%D.10%












