A B C D E F均为短周期元素 其原子序数依次增大.已知:A的最外层电子数等于其电子层数;B的
| A、B、C、D、E、F均为短周期元素,其原子序数依次增大.已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素.根据以上信息回答下列问题: (1)B与D形成化合物BD2的结构式为______ (2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式______. (3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为______;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)______. (4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是______. (5)已知:2CD2(g) 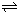 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示. 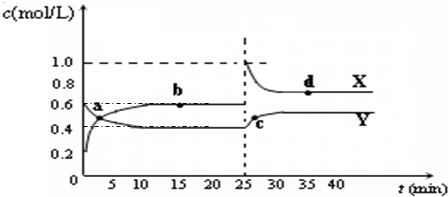 ①a、b、c、d四个点中,化学反应处于平衡状态的是______点. ②25min时,增加了______(填物质的化学式)______mol. ③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是______(填字母). |
参考解答
| A、B、C、D、E、F均为短周期元素,其原子序数依次增大.B的最外层电子数是次外层电子数的两倍,则B有2个电子层,最外层有4个电子,则B为碳元素;A的最外层电子数等于其电子层数,原子序数小于碳元素,则A为氢元素;D是地壳中含量最高的元素,则D为氧元素;C元素介于氧元素与碳元素之间,则C为氮元素;D和F同主族,则F为硫元素;A和E同主族,E是所有短周期主族元素中原子半径最大的元素,则E为钠元素. (1)B与D形成化合物BD2为CO2,CO2中碳原子与氧原子之间形成2对共用电子对,结构式为O═C═O. 故答案为:O═C═O. (2)A、C、D三元素能形成一种强酸甲,甲为HNO3,单质B为碳单质,碳与浓硝酸反应的方程式为 C+4HNO3(浓)
故答案为:C+4HNO3(浓)
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,则该两种盐为NaHSO4、NaHSO3,二者反应的离子方程式为H++HSO3-═SO2↑+H2O,由B、D、E组成的盐为 Na2CO3,碳酸钠是强碱弱酸盐,碳酸根水解 CO32-+H2O  HCO3-+OH-,使溶液呈碱性. 故答案为:H++HSO3-═SO2↑+H2O; CO32-+H2O  HCO3-+OH-. (4)C2A4是N2H4,N2H4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.原电池正极发生还原反应,氧气在正极放电,正极的电极反应式是O2+2H2O+4e-═4OH-. 故答案为:O2+2H2O+4e-═4OH-. (5)发生反应2NO2(g) 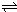 N2O4(g);△H<0.由图可知平衡时,X为生成物,X的浓度变化为0.4mol/L,Y为反应物,Y的浓度变化为0.2mol/L,所以X为NO2,Y为N2O4. ①浓度不变时处于平衡状态,由图可知,bd处于平衡状态. 故答案为:bd. ②由图可知平衡时,X为生成物,X的浓度变化为0.4mol/L,Y为反应物,Y的浓度变化为0.2mol/L,所以X为NO2,Y为N2O4.25min时,X的浓度瞬间增大,X的浓度增大为0.4mol/L,Y的浓度瞬间不变,所以应该增加了NO2,增加二氧化氮的物质的量为0.4mol/L×2L=0.8mol. 故答案为:NO2; 0.8. ③二氧化氮的浓度越大,气体颜色越深,所以a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是 cdba. 故答案为:cdba. |
相似问题
①a b c d e f g为七种由短周期元素构成的粒子 它们都有10个电子 其结构特点如下:其中b
①a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分
某元素X的气态氢化物的化学式是H2X 且X在其最高价氧化物中的质量分数为40% 则该元素是( )A
某元素X的气态氢化物的化学式是H2X,且X在其最高价氧化物中的质量分数为40%,则该元素是( )A.MgB.SC.CaD.O
下列叙述正确的是( )A.若R2-和M+的电子层结构相同.则离子半径R2-<M+B.标准状况下 1
下列叙述正确的是( )A.若R2-和M+的电子层结构相同.则离子半径R2-<M+B.标准状况下,11 2L氮气和氧气的混合气所舍原子数约为6 02×1023C.PH3和HC
A B C D E F六种元素 其中A B C D E为短周期主族元素.它们之间的关系如下:Ⅰ.原子
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:Ⅰ.原子半径:A<C<B<E<DⅡ.原子的最外层电子数:A=DC=EA+B=C
A B C D都是短周期元素 原子半径:D>C>A>B.已知:A B同周期 A C处于同一主族;C原
A、B、C、D都是短周期元素,原子半径:D>C>A>B.已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层












