A B C D都是短周期元素 原子半径:D>C>A>B.已知:A B同周期 A C处于同一主族;C原
| A、B、C、D都是短周期元素,原子半径:D>C>A>B.已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的3倍.试回答: (1)写出元素的名称:A______、C______. (2)写出由B、D组成的两种化合物的电子式分别为:______、______. (3)C的固态氧化物属于______晶体.写出表示C的氧化物的一种重要的工业用途______. (4)A、C的最高价氧化物对应水化物中酸性较强的是______(写水化物的分子式). (5)写出C的氧化物与D的最高价氧化物对应水化物反应的离子方程式______. |
参考解答
| 由A、C同主族,原子半径C>A,则A、C电子数相差8,C原子核内的质子数等于A、B原子核内的质子数之和,推出B原子的质子数为8,即B为O元素,C为第三周期元素,由C原子最外层电子数是D原子最外层电子数的3倍,若D最外层为1个电子,则C最外层为3个电子,若D最外层是2个电子,则C最外层是6个电子,则C与B是同主族元素了,不符合题意,故C为Al元素,D为Na元素,A为B元素, (1)A为B元素,C为Al元素,故答案为:硼;铝; (2)由B、D组成的两种化合物分别为Na2O、Na2O2,都属于离子化合物,电子式分别为 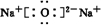 、  , 故答案为: 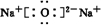 ;  ; (3)C为Al元素,对应的氧化物为Al2O3,为离子化合物,熔点高、硬度大,常用作耐火材料,也常用于电解冶炼铝的原料,故答案为:离子;作耐火材料或电解冶铝; (4)A、C的最高价氧化物对应水化物分别为H3BO3、Al(OH)3,其中H3BO3为一元酸,Al(OH)3为两性氢氧化物,酸性强的是H3BO3,故答案为:H3BO3; (5)Al2O3为两性氧化物,能与NaOH溶液反应,反应的离子方程式为,故答案为:Al2O3+2OH-+3H2O═2[Al(OH)4-. |
相似问题
X Y Z W四种元素的原子序数依次增大 且均为短周期元素.X原子最外层电子数是次外层电子数的2倍;
X、Y、Z、W四种元素的原子序数依次增大,且均为短周期元素.X原子最外层电子数是次外层电子数的2倍;Y有两种常见的同素异形体,其中一种是很好的脱色剂和
现有五种短周期主族元素x Y Z W R.其中X的原子半径时短周期最大的 Y的原子最外层电子数为m
现有五种短周期主族元素x、Y、Z、W、R.其中X的原子半径时短周期最大的,Y的原子最外层电子数为m,次外层电子数为n,Z的原子L层电子数为m+n,M层电子数为
现有几种元素的性质或原子结构如下表:元素编号元素性质或原子结构T失去一个电子后 形成Ne原子电子层结
现有几种元素的性质或原子结构如下表:元素编号元素性质或原子结构T失去一个电子后,形成Ne原子电子层结构X最外层电子数是次外层电子数的2倍Y其单质之一
A B C D四种元素分布在三个不同的短周期 它们的原子序数依次增大 其中B与C为同一周期 A与D为
A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的原子核外电子总数是电子层数的4倍,D
有X Y Z W四种短周期主族元素 原子序数依次增大.其中X Z同主族 Y W同周期 X原子的最外层
有X、Y、Z、W四种短周期主族元素,原子序数依次增大.其中X、Z同主族,Y、W同周期,X原子的最外层电子数是核外电子层数的3倍;Y的最高正价是W的最低负价












