Ⅰ下列描述中正确的是( )A.CS2为V形的极性分子B.的空间构型为平面三角形C.SF6中有6对
Ⅰ下列描述中正确的是( )
(1)Ni原子的核外电子排布式为__________________________________; (2)NiO、FeO的晶体结构类型均与氯化钠的相同, 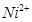 和 和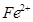 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”); 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);(3)NiO晶胞中Ni和O的配位数分别为_________________、_________________; (4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________________; 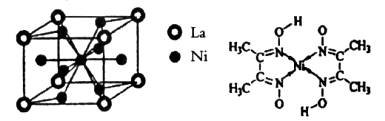 (5)丁二酮肟常用于检验 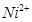 :在稀氨水介质中,丁二酮肟与 :在稀氨水介质中,丁二酮肟与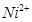 反应可生成鲜红色沉淀,其结构如右上图所示。 反应可生成鲜红色沉淀,其结构如右上图所示。①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是_________________。氮镍之间形成的化学键是_________________; ②该结构中,氧氢之间除共价键外还可存在_________________键; ③该结构中,碳原子的杂化轨道类型有_________________。 |
参考解答
(20分)Ⅰ. (6分)C、D Ⅱ. (14分)(1)[Ar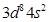 (2)> (3)6,6 (2)> (3)6,6 (4) 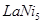 (5)①一个σ键、一个π键、配位键 ②氢键 ③sp2、sp3(每空1分) (5)①一个σ键、一个π键、配位键 ②氢键 ③sp2、sp3(每空1分) |
试题分析:Ⅰ.CS2分子中中心原子碳原子含有的孤对电子对数=(4-2×2)÷2=0,所以该分子是直线型结构,属于含有极性键的非极性分子,A不正确;ClO3-中中心原子氯原子含有的孤对电子对数=(7+1-3×2)÷2=1,所以该微粒是三角锥形结构,B不正确;在SF6分子中,S和F形成的是极性键,6个共价键完全是相同,即有6对完全相同的成键电子对,C正确;SiF4和 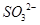 的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,D正确,答案选CD。 的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,D正确,答案选CD。Ⅱ.(1)Ni的原子序数是28,则根据构造原理可知,Ni原子的核外电子排布式为[Ar 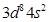 。 。(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO。 (3)因为Ni0、Fe0的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni和O的配位数也均为6。 (4)根据晶胞结构,并依据均摊法可知,晶胞中镧原子数= 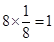 。镍原子数= 。镍原子数=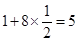 ,所以化学式为LaNi5。 ,所以化学式为LaNi5。(5)①碳和氮形成双键,双键是由一个σ键和一个π键构成;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键。 ②氧原子与氢原子之间可以形成氢键。 ③在该结构中碳原子既有单键又有双键,因此杂化类型是sp2和sp3杂化。 点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。题时注意电子排布式的书写方法,晶体熔点比较方法,分子空间构型的判断方法以及晶胞的有关计算,注意学习中有关做题方法的积累和总结。 |
相似问题
下列物质中 属于分子晶体的是( )①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸A.②④⑤B.①②④C.
下列物质中,属于分子晶体的是( )①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸A.②④⑤B.①②④C.②③④⑤D.①②③⑤
NaF NaI MgO均为离子化合物 根据下列数据 这三种化合物的熔点高低顺序是:( )物质①
NaF、NaI、MgO均为离子化合物,根据下列数据,这三种化合物的熔点高低顺序是:( )物质①NaF②NaI③MgO离子电荷数112键长(10-10m)2 313 182 10A.①>②>
(12分)已知:G Q R T X Y Z都是周期表中前四周期的元素 它们的核电荷数依次增大。G的简
(12分)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子
下列化学式能真实表示物质分子组成的是A.NaOHB.SO3C.CsClD.SiO2
下列化学式能真实表示物质分子组成的是A.NaOHB.SO3C.CsClD.SiO2
【化学—选修5:物质结构与性质】(15分)现有A B C D E原子序数依次增大的五种元素 它们位于
【化学—选修5:物质结构与性质】(15分)现有A、B、C、D、E原子序数依次增大的五种元素,它们位于元素周期表的前四周期。A元素原子的价层电子总数是内层


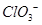 的空间构型为平面三角形
的空间构型为平面三角形









