【化学—选修5:物质结构与性质】(15分)现有A B C D E原子序数依次增大的五种元素 它们位于
| 【化学—选修5:物质结构与性质】(15分) 现有A、B、C、D、E原子序数依次增大的五种元素,它们位于元素周期表的前四周期。A元素原子的价层电子总数是内层电子总数的2倍;C元素原子的L电子层中只有两对成对电子;D元素与E元素在同周期相邻的族,它们的原子序数相差3,且D元素的基态原子有4个未成对电子。请回答下列问题: ⑴A、B、C三种元素的名称分别为 、 、 。 ⑵用元素符号表示A、B、C三种元素的第一电离能由低到高的排序为 。 ⑶E元素基态原子的核外电子排布式为 。 ⑷A元素与氢元素能形成种类繁多的化合物,其中只含sp3杂化且相对分子质量最小的分子的VSEPR空间构型为 ;其中只含sp2杂化且相对分子质量最小的化合物的结构式为 ;其中同时含sp杂化、SP2杂化、sp3杂化且相对分子质量最小的化合物的化学式为 。 ⑸A元素的一种单质的晶体结构如图甲所示,D元素的一种单质的晶体结构如图乙所示。 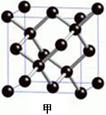 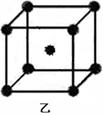 图甲中A原子的配位数与图乙中D原子的配位数之比为 。 |
参考解答
⑴碳(1分)、氮(1分)、氧(1分)⑵C、O、N(2分)⑶[Ar]3d104s1(2分)⑷正四面体(2分)、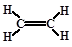 (2分),C5H6(2分)⑸1/2(2分) (2分),C5H6(2分)⑸1/2(2分) |
| 根据元素的结构即性质可知,A、B、C、D、E分别是C、N、O、Fe、Cu。 (1)A、B、C三种元素的名称分别为碳、氮、氧。 (2)非金属性越浅,第一电离能越大。氮氮原子的2p轨道电子处于半充满状态,稳定性强,第一电离能大于氧原子的,即第一电离能由低到高的排序为C、O、N。 (3)根据构造原理可知,铜元素基态原子的核外电子排布式为[Ar]3d104s1。 (4)只含sp3杂化且相对分子质量最小的分子是甲烷,由于碳原子不存在孤对电子,所以构型是正四面体。只含sp2杂化且相对分子质量最小的化合物是乙烯,其结构简式为 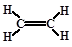 。时含sp杂化、SP2杂化、sp3杂化且相对分子质量最小的化合物的化学式C5H6。 。时含sp杂化、SP2杂化、sp3杂化且相对分子质量最小的化合物的化学式C5H6。(5)金刚石中碳原子的配位数是4,铁晶体中配位数是8,所以配位数之比为1︰2。 |
相似问题
测知氯化钠晶体中相邻的Na+离子与Cl-离子的距离为a cm 该晶体密度为ρg/cm3 则阿伏加德罗
测知氯化钠晶体中相邻的Na+离子与Cl-离子的距离为a cm,该晶体密度为ρg cm3,则阿伏加德罗常数可表示为A.0 585 4a3ρB.58 5 8a3ρC.58 5 2a3ρD.117 a3ρ
下列说法不正确的是( ) A.HCl HBr HI的熔 沸点依次升高与分子间作用力大小有关B.H2
下列说法不正确的是( )A.HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关B.H2O的熔、沸点高于H2S是由于H2O分子之间存在氢键C.甲烷可与水形
(5分)(1)下列数据是对应物质的熔点(℃)NaClNa2OAlF3AlCl3BCl3Al2O3CO
(5分)(1)下列数据是对应物质的熔点(℃)NaClNa2OAlF3AlCl3BCl3Al2O3CO2SiO28019201291190-1092073-571723据此作出的下列判断中,错误的是A.铝的化
下列有关金属的说法不正确的是A.金属的导电性 导热性 延展性都与自由电子有关B.六方最密和面心立方最
下列有关金属的说法不正确的是A.金属的导电性、导热性、延展性都与自由电子有关B.六方最密和面心立方最密的原子堆积方式空间利用率最高C.钠晶胞结构如
共价键 金属键 离子键和分子间作用力都是构成物质微粒间的不同相互作用 含有上述中两种相互作用的晶体是
共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,含有上述中两种相互作用的晶体是()A.SiO2晶体B.Ar晶体C.NaCl晶体D.NaOH晶体












