(12分)已知:G Q R T X Y Z都是周期表中前四周期的元素 它们的核电荷数依次增大。G的简
| (12分)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列。 回答下列问题: ⑴Z的核外电子排布式是 。 ⑵X以及与X左右相邻的两种元素,其第一电离能由小到大的顺序为 。 ⑶QR2分子中,Q原子采取 杂化,写出与QR2互为等电子体的一种分子的化学式: 。 ⑷分子式为Q2G6R的物质有两种,其中一种易溶于水,原因是 ;T的氯化物的熔点比Y的氯化物的熔点高,原因是 。 ⑸据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如图所示。晶体中距每个X原子周围距离最近的Q原子有 个。 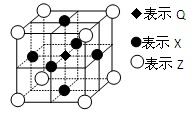 |
参考解答
| ⑴1s22s22p63s23p63d84s2 ⑵Na<Al<Mg ⑶sp N2O(或CS2等) ⑷该物质分子与水分子形成氢键 B、D的固态氯化物分别属于离子晶体和分子晶体,离子晶体的熔点一般高于分子晶体 ⑸2 |
| 根据元素的结构及其性质可知,G、Q、R、T、X、Y、Z分别是H、C、O、Na、Mg、Si、Ni。 (1)根据构造原理可知,镍原子的核外电子排布式是1s22s22p63s23p63d84s2 。 (2)镁自由相邻的是钠和铝,金属性越强,第一电离能越小。由于镁原子的3s轨道电子是全充满状态,稳定性强,第一电离能大于铝的,所以第一电离能由小到大的顺序为Na<Al<Mg。 (3)CO2是直线型结构,碳原子是sp杂化。价电子和原子数分别都相等的是等电子体,所以和CO2互为等电子体的是N2O。 (4)乙醇分子能与水分子形成氢键,且乙醇是极性分子,乙醚是非极性分子,根据相似相溶原理可知,乙醇易溶于水。氯化钠形成的晶体是离子晶体,四氯化硅形成的是分子晶体,离子晶体的熔点一般高于分子晶体。 (5)根据晶胞可知,晶体中距每个X原子周围距离最近的Q原子有4÷2=2个。 |
相似问题
下列化学式能真实表示物质分子组成的是A.NaOHB.SO3C.CsClD.SiO2
下列化学式能真实表示物质分子组成的是A.NaOHB.SO3C.CsClD.SiO2
【化学—选修5:物质结构与性质】(15分)现有A B C D E原子序数依次增大的五种元素 它们位于
【化学—选修5:物质结构与性质】(15分)现有A、B、C、D、E原子序数依次增大的五种元素,它们位于元素周期表的前四周期。A元素原子的价层电子总数是内层
测知氯化钠晶体中相邻的Na+离子与Cl-离子的距离为a cm 该晶体密度为ρg/cm3 则阿伏加德罗
测知氯化钠晶体中相邻的Na+离子与Cl-离子的距离为a cm,该晶体密度为ρg cm3,则阿伏加德罗常数可表示为A.0 585 4a3ρB.58 5 8a3ρC.58 5 2a3ρD.117 a3ρ
下列说法不正确的是( ) A.HCl HBr HI的熔 沸点依次升高与分子间作用力大小有关B.H2
下列说法不正确的是( )A.HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关B.H2O的熔、沸点高于H2S是由于H2O分子之间存在氢键C.甲烷可与水形
(5分)(1)下列数据是对应物质的熔点(℃)NaClNa2OAlF3AlCl3BCl3Al2O3CO
(5分)(1)下列数据是对应物质的熔点(℃)NaClNa2OAlF3AlCl3BCl3Al2O3CO2SiO28019201291190-1092073-571723据此作出的下列判断中,错误的是A.铝的化












