(I)在铝热反应 Fe2O3+2Al 高温 . 2Fe+Al2O3 中 作为氧化剂的物质是_____
(I)在铝热反应 Fe2O3+2Al
(II)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有______和______; (III)原电池是一种将______能转化为______能的装置.在Cu-Zn原电池中,Zn极发生______反应,电极反应式为______. 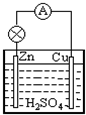 |
参考解答
(I)Fe2O3+2Al
故答案为:Fe2O3;Al. (II)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.根据此现象判断,反应速率与反应物的浓度、温度有关. 故答案为:温度;浓度. (III)原电池的定义:把化学能转变为电能的装置;在Cu-Zn原电池中,Zn失电子变成离子进入溶液,所以锌发生氧化反应,电极反应式为Zn-2e-=Zn2+; 故答案为:化学;电;氧化;Zn-2e-=Zn2+. |
相似问题
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色 无臭 在潮湿的空气中能发生下列反应
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O2NO+HNO3+9HF,下列有关说法正确的是( )
将25.6g铜与含0.3molH2SO4的浓硫酸充分反应 (1)若在反应过程中消耗了0.2mol的H
将25.6g铜与含0.3molH2SO4的浓硫酸充分反应,(1)若在反应过程中消耗了0.2mol的H2SO4,则生成的气体标况下体积为多少?(2)若以上反应产生的气体全
下列观点中不正确的是[ ]A 通过化学变化一定能改变物质的性质 B 人们所使用的材料 都是纯
下列观点中不正确的是[ ]A、通过化学变化一定能改变物质的性质 B、人们所使用的材料,都是纯度越高越好 C、氧化还原反应中一定会发生电子转移 D、某
(10分)有三份不同质量的铁粉样品①②③ 甲 乙 丙三位同学各取一份样品分别与含有0.8molHNO
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0 8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只
用0.1 mol/L的Na2SO3溶液30 mL 恰好将2×10-3 mol XO4-还原 则元素X
用0 1 mol L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是A.+4B.+3C.+2D.+1












