(10分)有三份不同质量的铁粉样品①②③ 甲 乙 丙三位同学各取一份样品分别与含有0.8molHNO
| (10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题: (1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。 (2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。 (3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是 物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。 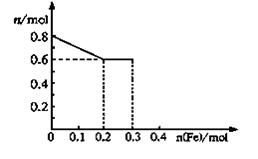 |
参考解答
⑴11.2g ⑵11.2<a<16.8 ⑶NO3- 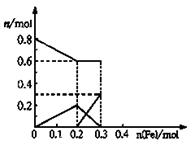 |
试题分析:⑴设Fe的物质的量是x,则生成硝酸铁也是x,所以被还原的硝酸是0.8mol-3x。根据电子的得失守恒可知,3x=3×(0.8mol-3x),解得x=0.2mol,所以铁的质量是0.2mol×56g/mol=11.2g。 ⑵如果铁的氧化产物是亚铁离子,则生成硝酸亚铁是x,所以被还原的硝酸是0.8mol-2x。根据电子的得失守恒可知,2x=3×(0.8mol-2x),解得x=0.3mol,所以铁的质量是0.3mol×56g/mol=16.8g。因此如果是反应后的溶液中既含有Fe3+,又含有Fe2+,则样品②的质量是11.2<a<16.8。 ⑶由于最初溶液中NO3-的物质的量就是0.8mol,所以曲线表示的是NO3-的物质的量变化的曲线;根据反应的方程式Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、2Fe(NO3)3+Fe= 3Fe(NO3)2可知,铁离子的最大值是0.2mol。如果继续加入铁,则开始生成亚铁离子,亚铁离子的最大值是0.3mol;综上分析便可画出Fe3+、Fe2+离子的物质的量的变化曲线。 |
相似问题
用0.1 mol/L的Na2SO3溶液30 mL 恰好将2×10-3 mol XO4-还原 则元素X
用0 1 mol L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是A.+4B.+3C.+2D.+1
下列反应不属于四种基本反应类型 但属于氧化还原反应的是( )A.Fe+CuSO4=FeSO4+Cu
下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A.Fe+CuSO4=FeSO4+CuB.3CO+Fe2O3高温 2Fe+3CO2C.AgNO3+NaCl=AgCl↓+NaNO3D.2KMnO4△ K2MnO4+MnO2+O2↑
氧化还原反应的实质是 [ ]A.分子中的原子重新组合 B.氧元素的得失 C.电子的得失或共用
氧化还原反应的实质是[ ]A.分子中的原子重新组合 B.氧元素的得失 C.电子的得失或共用电子对的偏移D.化合价的改变
19.2g铜与适量的浓HNO3反应 铜全部反应后 共收集到11.2 LNO和NO2混合气体(标准状况
19 2g铜与适量的浓HNO3反应,铜全部反应后,共收集到11 2 LNO和NO2混合气体(标准状况),反应消耗HNO3的物质的量是()A.0 8 molB.1 1 molC.1 2 molD.2 0 mol
近年来 高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:(1)第①步中采用铁坩埚而












