(1)电解饱和食盐水之前食盐水需要精制 目的是除去粗盐中的Ca2+ Mg2+ SO42-等杂质离子
| (1)电解饱和食盐水之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂和操作有a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,d.过滤,其合理的加入顺序为________(填字母代号)。 (2)电解饱和食盐水时离子交换膜的作用是_____________________________ (3)电解饱和食盐水时,如果在容积为10 L的离子交换膜电解槽中,1 min在阳极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设体积维持不变)________。 (4)Cl2常用于自来水的杀菌消毒,现有一种新型消毒剂ClO2,若它们在杀菌过程中还原产物均为Cl-,消毒等量的自来水,所需Cl2和ClO2的物质的量之比为________。 |
参考解答
| (1)badc (2)防止Cl2与NaOH反应 防止Cl2与H2混合爆炸 (3)13 (4)5∶2 |
(4)Cl2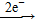 2Cl-,ClO2 2Cl-,ClO2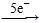 Cl-,故所需Cl2和ClO2的物质的量之比为5∶2。 Cl-,故所需Cl2和ClO2的物质的量之比为5∶2。 |
相似问题
在一定条件下 XO3n-和氟气可发生如下反应:XO3n-+F2+2OH-=XO4-+2F-+H2O
在一定条件下,XO3n-和氟气可发生如下反应:XO3n-+F2+2OH-=XO4-+2F-+H2O,从而可知在XO3n-中,元素X的化合价是[ ]A.+4 B.+5C.+6D.+7
在热的稀硫酸中溶解了11.4 g FeSO4固体 当加入50 mL 0.5 mol·L-1 KNO3
在热的稀硫酸中溶解了11 4 g FeSO4固体,当加入50 mL 0 5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。(1)
半导体生产中常需要控制掺杂 以保证控制电阻率 三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置
汽车剧烈碰撞时 安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑。若氧
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )A.生成40.0LN2(标
有关氧化还原反应实质的说法中正确的是[ ]A.是否有电子转移 B.是否有元素化合价的变化 C
有关氧化还原反应实质的说法中正确的是[ ]A.是否有电子转移 B.是否有元素化合价的变化 C.是否有氧元素的参加 D.是否有原子的重新组合












