在热的稀硫酸中溶解了11.4 g FeSO4固体 当加入50 mL 0.5 mol·L-1 KNO3
| 在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。 (1)推算出x= ;y= 。 (2)配平该反应的方程式: FeSO4+ KNO3+ H2SO4= K2SO4+ Fe2(SO4)3+  (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 中)。 中)。(3)反应中氧化产物是 。 (4)用双线桥法表示该反应中的电子转移方向和数目: 。 |
参考解答
| (1)1 1 (2)6 2 4 1 3 2 NO↑ 4 (3)Fe2(SO4)3 (4)  +4H2O |
n(FeSO4)=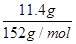 =0.075 mol =0.075 moln(KNO3)=0.05 L×0.5 mol·L-1=0.025 mol Fe2+转化为Fe3+共失去0.075 mol电子,根据得失电子守恒原理,可知1 mol N原子得到3 mol电子,反应中N元素由+5价降为+2价,既得到的氧化物为NO。 |
相似问题
半导体生产中常需要控制掺杂 以保证控制电阻率 三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置
汽车剧烈碰撞时 安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑。若氧
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )A.生成40.0LN2(标
有关氧化还原反应实质的说法中正确的是[ ]A.是否有电子转移 B.是否有元素化合价的变化 C
有关氧化还原反应实质的说法中正确的是[ ]A.是否有电子转移 B.是否有元素化合价的变化 C.是否有氧元素的参加 D.是否有原子的重新组合
将KClO3 I2各0.02 mol加入12 g 36.5%的盐酸中 I2恰好完全溶解 没有气体产生
将KClO3、I2各0 02 mol加入12 g 36 5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发)。将反应后的溶液用冰水冷却,析出橙红色晶体A(A在
(14分)Q W X Y Z是周期表前36号元素中的五种常见元素 其原子序数依次增大。W原子最外层电
(14分)Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W原子最外层电子数与核外电子总数之比为3∶4,Q、Y的氧化物是导致酸雨












