(14分)Q W X Y Z是周期表前36号元素中的五种常见元素 其原子序数依次增大。W原子最外层电
(14分)Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W原子最外层电子数与核外电子总数之比为3∶4,Q、Y的氧化物是导致酸雨的主要物质,X是地壳中含量最高的金属元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。以下问题均有化学用语回答 (1)Q单质的电子式为_______。 (1)Q单质的电子式为_______。 W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。 W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。 (2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。 (2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。(3)Na2Y溶液中离子浓度由大到小的顺序为____________________________________________。  (4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。 (4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。(5)ZCl2溶液中混有FeCl3杂质时,可加入_____________(填试剂)调节pH=_________,再过滤。已知:Fe(OH)3的Ksp=10-35,化学上认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。 (6)工业上可用高温条件下Z2Y + O2=2Z + YO2来冶炼金属Z,生成1molZ时转移____mol电子。 |
参考解答
 (1) (1) 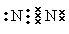 (1分) S2->O2->Al3+(2分) (1分) S2->O2->Al3+(2分) (2)Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑(2分) (2)Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑(2分)(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) (2分)  (4)3CuO + 2NH3 (4)3CuO + 2NH3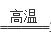 3Cu + N2 + 3H2O (2分) 3Cu + N2 + 3H2O (2分)(5)CuO(1分) pH=4 (2分) (6)3 (2分) |
试题分析:Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。Q、Y的氧化物是导致酸雨的主要物质,则Q是氮元素,Y是硫元素。X是地壳中含量最高的金属元素,因此X是铝元素。Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,所以Z是铜元素。W原子最外层电子数与核外电子总数之比为3∶4,且原子序数介于氮元素与铝元素之间,因此W是氧元素,则  (1)氮气分子中含有氮氮三键,单质的电子式为 (1)氮气分子中含有氮氮三键,单质的电子式为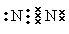 。 。 离子核外电子层数越多,离子半径越大。在核外电子排布相同的条件下原子序数越小离子半径越大,则W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+。 离子核外电子层数越多,离子半径越大。在核外电子排布相同的条件下原子序数越小离子半径越大,则W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+。 (2)X和Y组成的化合物是硫化铝,溶于水与水反应生成氢氧化铝和硫化氢,则放入水中反应的化学方程式是Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑。 (2)X和Y组成的化合物是硫化铝,溶于水与水反应生成氢氧化铝和硫化氢,则放入水中反应的化学方程式是Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑。(3)Na2S溶液中硫离子水解,溶液显碱性,则溶液中离子浓度由大到小的顺序为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。  (4)CuO在高温下被氨气还原为铜单质,而氨气的还原产物是氮气,根据原子守恒还有水生成,则反应的化学方程式为3CuO + 2NH3 (4)CuO在高温下被氨气还原为铜单质,而氨气的还原产物是氮气,根据原子守恒还有水生成,则反应的化学方程式为3CuO + 2NH3 3Cu + N2 + 3H2O。 3Cu + N2 + 3H2O。(5)由于除杂时不能引入新的杂质,则CuCl2溶液中混有FeCl3杂质时,可加入CuO调节pH。当溶液中铁离子浓度为1×10-5mol/L时,此时溶液中氢氧根离子浓度为 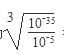 =10-10mol/L,则溶液pH对于4,因此最终调解pH=4,再过滤。 =10-10mol/L,则溶液pH对于4,因此最终调解pH=4,再过滤。(6)根据Cu2S + O2=2Cu +SO2可知,只有硫元素的化合价从-2价升高到+4价,失去6个电子,因此生成1molZ时转移3mol电子。 |
相似问题
两种大气污染物NO2和SO2在一定条件下可以发生如下反应:NO2+SO2=' NO' +SO3 在体
两种大气污染物NO2和SO2在一定条件下可以发生如下反应:NO2+SO2=" NO" +SO3,在体积为V L的密闭容器中通入3molNO2和5molSO2, 反应后容器内氮原子和氧
a mol FeS与b mol FeO投入到V L c mol/L的硝酸溶液中充分反应 产生NO气体
a mol FeS与b mol FeO投入到V L、c mol L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮用水处理的新技术。已知反应Fe2O3+3Na2O2=
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮用水处理的新技术。已知反应Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是( )A.Na2O2既是氧化剂又
用高铁酸钠(Na2FeO4)对水消毒是城市饮用水处理的新技术。已知反应:Fe2O3+3Na2O2=2
用高铁酸钠(Na2FeO4)对水消毒是城市饮用水处理的新技术。已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是A.Na2O2既是氧化剂又是还原剂B.Na2
某反应体系的物质有:NaOH Au2O3 Na2S4O6 Na2S2O3 Au2O H2O。(1)请
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。(2)反应中,被还原的元素是,还












