某反应体系的物质有:NaOH Au2O3 Na2S4O6 Na2S2O3 Au2O H2O。(1)请
| 某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。 (1)请将Au2O3之外的反应物与生成物分别填入以下空格内。 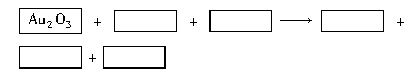 (2)反应中,被还原的元素是 ,还原剂是 。 (3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。  (4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。 |
参考解答
(1)Na2S2O3H2ONa2S4O6Au2ONaOH(2)AuNa2S2O3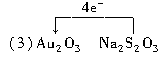 (4)1:4 (4)1:4 |
| 因为Au2O3为反应物,则Au2O必定为生成物,在Au2O3中Au的化合价为+3价,Au2O中Au的化合价为+1价,即Au在反应中化合价降低,则另一种元素的化合价必定升高,在Na2S2O3中S的化合价为+2价,Na2S4O6中S的化合价为+2.5价,所以Na2S2O3为反应物,Na2S4O6为生成物,根据化合价的升降总值相等,在Na2S4O6前配2,由S守恒,可知Na2S2O3前配4,Au2O3和Au2O前分别配1,再根据Na+守恒,则生成物中必定为NaOH,且配平系数为4,则H2O为反应物,在其前面配2,配平后的化学方程式为:Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH。 |
相似问题
下列各项所述的关系正确的是[ ]A.有电子转移是氧化还原反应的本质 有元素化合价的变化是氧化
下列各项所述的关系正确的是[ ]A.有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外观表现 B.一种物质被氧化,必然有一种物质
下列反应中属于氧化还原反应的是( )A.CaCO3 高温 . CaO+CO2↑B.CaO+H2O=
下列反应中属于氧化还原反应的是( )A.CaCO3高温 CaO+CO2↑B.CaO+H2O=Ca(OH)2C.Na2CO3+2HCl=2NaCl+H2O+CO2↑D.4HNO3(浓)△ 4NO2↑+O2↑+2H2O
单质钛的机械强度高 抗腐蚀能力强 有“未来金属”之称.工业上常用硫酸分解钛铁矿(主要成分是钛酸亚铁F
单质钛的机械强度高,抗腐蚀能力强,有“未来金属”之称.工业上常用硫酸分解钛铁矿(主要成分是钛酸亚铁FeTiO3)的方法来制取TiO2,再由TiO2制金属钛.
木炭与浓硫酸反应可表示为:C +2H2SO4(浓) CO2↑+2SO2↑+2H2O。(1)该反应的反
木炭与浓硫酸反应可表示为:C +2H2SO4(浓)CO2↑+2SO2↑+2H2O。(1)该反应的反应物和生成物中,属于氧化物的是。(2)木炭作(填“氧化剂”或“还原剂”
取x g铜镁合金完全溶于浓硝酸中 反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 m
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量












