(8分)工业甲醇的质量分数可以用下列方法测定:①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H
| (8分)工业甲醇的质量分数可以用下列方法测定: ①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O, 反应式为:CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O; ②过量的Cr2O72—可用Fe2+与之完全反应: ___Cr2O72—+___Fe2++____H+ —_____Cr3++____Fe3++____H2O 现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。 (1)配平第②步的离子方程式___________________________ (2)计算工业甲醇的质量分数。 |
参考解答
(8分)⑴1、6、14、2、6、7 (2分)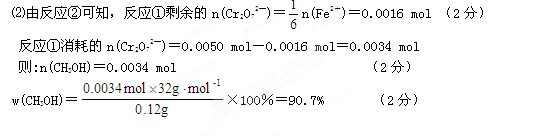 |
| (1)考查氧化还原反应方程式的配平。根据方程式可知,Cr元素的化合价从+6价降低到+3价,得到3个电子;铁元素的化合价从+2价升高到+3价,失去1个电子,所以根据电子的得失守恒可知,配平后的化学计量数依次是1、6、14、2、6、7。 (2)考查根据方程式进行的有关计算。 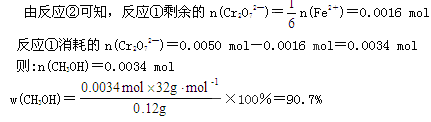 。 。 |
相似问题
某溶液中阳离子只含K+ 其中Cl- Br- I-的个数比为1∶2∶3 欲使这些离子个数比变为3∶2∶
某溶液中阳离子只含K+,其中Cl-、Br-、I-的个数比为1∶2∶3,欲使这些离子个数比变为3∶2∶1,需要通入的氯分子与原溶液中I-的个数比应为( )A.1∶
在一定条件下 和氟气可发生如下反应: 从而可知在中 元素R的化合价( )A.+4B.+5 C
在一定条件下,和氟气可发生如下反应:,从而可知在中,元素R的化合价()A.+4B.+5 C.+6D.+7
把Cl2通入浓氨水中 发生下述反应:3Cl2 + 8NH3 = 6NH4Cl + N2 发生化学反应
把Cl2通入浓氨水中,发生下述反应:3Cl2 + 8NH3 = 6NH4Cl + N2,发生化学反应的Cl2与NH3的分子数之比为: ,反应中发生电子转移的Cl2与NH3的分子数之比为:
三氟化氮是微电子工业中优良的等离子刻蚀气体 它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+
三氟化氮是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下了有关该反应的说法正确的是:A.NF3是氧化剂,H2
实验室也可用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O来快速制
实验室也可用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O来快速制取氯气。(1)请标出电子的转移方向和数目2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H












