将7.28gFe溶于过量的稀H2SO4中 在加热的条件下 用2.02gKNO3去氧化溶液中Fe2+
将7.28gFe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/LKMnO4溶液25mL才能完全氧化,已知其反应方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。则KNO3的还原产物是
|
参考解答
| A |
试题分析:7.28gFe溶于过量的稀H2SO4中得到n(Fe2+)为0.13mol。加入KNO3和KMnO4后,NO3-和MnO4-将Fe2+氧化成Fe3+,设KNO3的还原产物中N的化合价为x,则失电子总数为0.13mol,得电子总数为 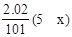 +0.4mol×0.025L×5=0.13,所以x=1,所以还原产物为N2O。答案选A。 +0.4mol×0.025L×5=0.13,所以x=1,所以还原产物为N2O。答案选A。点评:本题根据得失电子数相等计算简单。 |
相似问题
在bLFeBr2溶液中通入amolCl2时 使溶液中50%的Br-氧化为Br2 则原FeBr2的物质
在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )A.mol·L-1B.mol·L-1C.mol·L-1D.mol·L-1
向含有Fe2+ I- Br-的溶液中缓慢通入氯气 溶液中各种离子的物质的量变化如图所示。下列说法正确
向含有Fe2+、I-、Br-的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。下列说法正确的是A.B点时溶液中含有I-和Br-B.DE段表示n (Fe2+)的
Cu2S与一定浓度的HNO3反应 生成Cu(NO3)2 CuSO4 NO2 NO和H2O 当NO2和
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的体积相等时,实际参加反应的Cu2S与HNO3的物质的量之比为( )A.1∶7B.1∶5C.1∶9D.2∶9
(11分)实验室里 用MnO2与浓盐酸反应来制取适量的氯气。现用100mL的浓盐酸与MnO2反应 生
(11分)实验室里,用MnO2与浓盐酸反应来制取适量的氯气。现用100mL的浓盐酸与MnO2反应,生成的氯气在标准状况时的体积为5 6L,请计算:(1)用“双线桥
已知:还原性HSO—3>I— 氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入K
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0 3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不












