(11分)实验室里 用MnO2与浓盐酸反应来制取适量的氯气。现用100mL的浓盐酸与MnO2反应 生
| (11分)实验室里,用MnO2与浓盐酸反应来制取适量的氯气。现用100mL的浓盐酸与MnO2反应,生成的氯气在标准状况时的体积为5.6L,请计算: (1)用“双线桥法”标出电子转移情况 MnO2 + 4HCl(浓)  MnCl2 + Cl2↑ + 2H2O MnCl2 + Cl2↑ + 2H2O(2)理论上需要参加反应的二氧化锰多少克? (3)被氧化的HCl的质量为多少克? |
参考解答
| (11分) (1) 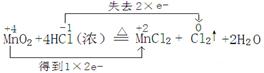 (3分) (3分)(2)(4分)21.75g (3)(4分)18.25g |
(1)在反应中,锰元素的化合价是+4价,生成物中是+2价,所以二氧化锰是氧化剂,转移2个电子。氯化氢中氯元素的化合价从-1价升高到0价,氯化氢是还原剂,所以方程式为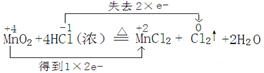 (2)生成的氯气在标准状况时的体积为5.6L,其物质的量是 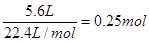 ,根据方程式可知 ,根据方程式可知MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O87g 1mol m 0.25mol 所以m=87g×0.25mol÷1mol=21.75g。 (3)根据氯原子守恒可知,被氧化的氯化氢是0.25mol×2×36.5g/mol=18.25g。 |
相似问题
已知:还原性HSO—3>I— 氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入K
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0 3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不
已知A2On2-可与B2-反应 B2-被氧化 产物为B单质 A2On2-被还原 产物为A3+;且知1
已知A2On2-可与B2-反应,B2-被氧化,产物为B单质,A2On2-被还原,产物为A3+;且知100mL c(A2On2-)=0 3mol L的溶液与150mL c(B2-)="0 " 6mol L的
常温下 在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉 产生气体的量随铁粉质量增加的变化
常温下,在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体, Fe的相对原
反应2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O 下列说法正确的是( )A.
反应2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,下列说法正确的是()A.H2CrO4是氧化剂,H2O是氧化产物B.若3mol H2O2完全反应,则反应中共转移了6NA个电
有一未完成的离子方程式____+XO3-+6H+=3X2+3H2O 据此判断 氧化产物和还原产物的物
有一未完成的离子方程式____+XO3-+6H+=3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为A.1∶1B.3∶1C.5∶1D.7∶1












