已知:还原性HSO—3>I— 氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入K
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是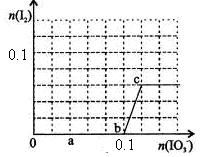
|
参考解答
| C |
试题分析:还原性HSO-3>I-,所以首先发生的离子反应是3HSO3-+IO3-=3SO42-+I-+3H+。继续加入KIO3,已知氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-=3H2O+3I2,根据发生的反应,则:A、根据图像可知,0~b间没有单质碘生成,所以反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+,A正确;B、根据图像可知,a点碘酸钾的物质的量是0.04mol,所以根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,消耗NaHSO3的物质的量为0.04mol×3=0.12mol,B正确;C、设生成的碘单质的物质的量为n,则溶液中I—的物质的量是2.5n。则根据反应IO3-+6H++5I-=3H2O+3I2可知,消耗的KIO3的物质的量为 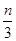 ,消耗碘离子的量为 ,消耗碘离子的量为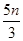 。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol- 。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol-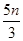 =2.5n,解得 =2.5n,解得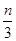 = =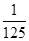 mol,所以消耗碘酸钾的物质的量是( mol,所以消耗碘酸钾的物质的量是(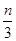 +0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。 +0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。 |
相似问题
已知A2On2-可与B2-反应 B2-被氧化 产物为B单质 A2On2-被还原 产物为A3+;且知1
已知A2On2-可与B2-反应,B2-被氧化,产物为B单质,A2On2-被还原,产物为A3+;且知100mL c(A2On2-)=0 3mol L的溶液与150mL c(B2-)="0 " 6mol L的
常温下 在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉 产生气体的量随铁粉质量增加的变化
常温下,在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体, Fe的相对原
反应2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O 下列说法正确的是( )A.
反应2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,下列说法正确的是()A.H2CrO4是氧化剂,H2O是氧化产物B.若3mol H2O2完全反应,则反应中共转移了6NA个电
有一未完成的离子方程式____+XO3-+6H+=3X2+3H2O 据此判断 氧化产物和还原产物的物
有一未完成的离子方程式____+XO3-+6H+=3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为A.1∶1B.3∶1C.5∶1D.7∶1
在反应8NH3+3Cl2=N2+6NH4Cl中 被还原物质与被氧化物质分子数之比[ ]A.
在反应8NH3+3Cl2=N2+6NH4Cl中,被还原物质与被氧化物质分子数之比[ ]A.8∶3B.3∶8C.3∶2D.1∶3












