我国目前使用碘酸钾作为食用盐中碘强化剂.并规定 食用盐碘含量的平均水平(以碘元素计)为20mg/kg
| 我国目前使用碘酸钾作为食用盐中碘强化剂.并规定,食用盐碘含量的平均水平(以碘元素计)为20mg/kg~30mg/kg. (1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并用单线桥标出电子转移. ______KIO3+______KI+______H2SO4=______K2SO4+______I2+______H2O (2)已知:I2+2S2O32-=2I-+S4O62-,某学生测定食用精制盐的碘含量,其步骤为: a.准确称取20g食盐,加适量蒸馏水使其完全溶解; b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全; c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol-L-1的Na2S2O3溶液10.0mL,恰好反应完全. ①判断c中反应恰好完全依据的现象是______. ②b中反应所产生的I2的物质的量是______mol. ③根据以上实验和包装袋说明,所测精制盐的碘含量是______mg/kg. |
参考解答
(1)该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,一个KI分子失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,其它元素根据原子守恒配平.故答案为: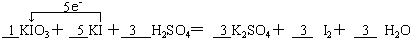 ; (2)①I2+2S2O32-=2I-+S4O62-,碘遇淀粉变蓝色,溶液中没有碘,溶液为无色,故答案为:溶液由蓝色恰好变为无色; ②I2+2S2O32-=2I-+S4O62-, 1mol 2 mol 1.0×10-5mol 2.0×10-3mol?L-1×0.01L 故答案为:1.0×10-5; ③KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O 碘酸钾中的碘 127g 3mol
设每千克食盐中含碘xmg,列比例式为
x=21,故答案为:21. |
相似问题
现有短周期元素组成的A B C D E五种物质 存在如下转化关系(部分产物已略去) 其中E为黑色粉末
现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.(1)若B为含氯元素的钾盐,与浓盐酸
将W g木炭与同时装入一个装有压力表体积不变的密闭容器中 压力表所示压强为 高温下容器中木炭与均完全
将W g木炭与同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为,高温下容器中木炭与均完全反应后恢复到原温度,压力表的示数为,试求:(1
美国科学家理查德·海克和日本科学家根岸英一 伶木彰因在研发“有机合成中的钯催化的交叉偶联”而获得诺贝
美国科学家理查德·海克和日本科学家根岸英一、伶木彰因在研发“有机合成中的钯催化的交叉偶联”而获得诺贝尔化学奖。有机合成常用的钯 活性炭催化剂,长
已知:①向KClO3晶体中滴加浓盐酸 产生黄绿色气体。②向NaI溶液中通入少量实验①产生的气体 溶液
已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体。②向NaI溶液中通入少量实验①产生的气体,溶液变黄色。③取实验②生成的溶液滴在淀粉KI试纸上,试纸
下列说法在一定条件下可以实现的是( )①非金属置换金属的反应 ②弱酸反应可以生成强酸 ③没有水生成
下列说法在一定条件下可以实现的是( )①非金属置换金属的反应 ②弱酸反应可以生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④有单质












