美国科学家理查德·海克和日本科学家根岸英一 伶木彰因在研发“有机合成中的钯催化的交叉偶联”而获得诺贝
美国科学家理查德·海克和日本科学家根岸英一、伶木彰因在研发“有机合成中的钯催化的交叉偶联”而获得诺贝尔化学奖。有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收,一种由废催化剂制取氯化钯的工艺流程如下: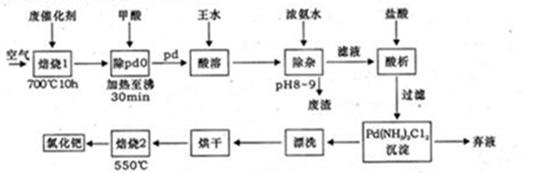 (1)甲酸还原氧化钯的化学方程式为 。 (2)钯在王水(浓硝酸与浓盐酸按体积比1:3)中转化为H2PdC14,硝酸被还原为NO,该反应的化学方程式为: 。 (3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如下图1—图3所示,则王水溶液钯精渣的适宜条件(温度、时间和王水用量)为 、 、 。 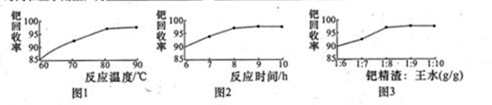 (4)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2—。此时铁的存在形式是 (写化学式) (5)700℃焙烧1的目的是: ;550℃焙烧2的目的是: 。 |
参考解答
(15分)(1)PdO+HCOOH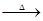 Pd+CO2↑+H2O(3分) Pd+CO2↑+H2O(3分)(2)3Pd+12HCl+2HNO3=3H2PdCl4+2NO↑+4H2O(3分) (3)80~90℃(或90℃左右)、反应时间约为8h、钯精渣与王水的质量比为1:8(3分) (4)Fe(OH)3(2分) (5)除去活性炭及有机物(2分);脱氨(将Pd(NH3)2Cl2转变为PdCl2)(2分) |
试题分析:(1)氧化钯的还原产物是Pd,而甲酸的氧化产物是CO2,所以甲酸还原氧化钯的化学方程式为)PdO+HCOOH 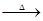 Pd+CO2↑+H2O。 Pd+CO2↑+H2O。(2)根据原子守恒可知,反应中还有水生成,因此反应的化学方程式是3Pd+12HCl+2HNO3=3H2PdCl4+2NO↑+4H2O。 (3)根据图1可知,80~90℃回收率最高。根据图2可知,反应进行到8h后,回收率几乎不再发生变化。根据图3可知,钯精渣与王水的质量比为1:8是回收率最高,所以王水溶液钯精渣的适宜条件是80~90℃(或90℃左右)、反应时间约为8h、钯精渣与王水的质量比为1:8。 (4)氨水溶液显碱性,所以铁的主要存在形式是Fe(OH)3。 (5)由于催化剂中含有活性炭以及有机物,所以700℃焙烧1的目的是除去活性炭及有机物;由于要把Pd(NH3)2Cl2转变为PdCl2,所以550℃焙烧2的目的是脱氨(将Pd(NH3)2Cl2转变为PdCl2)。 |
相似问题
已知:①向KClO3晶体中滴加浓盐酸 产生黄绿色气体。②向NaI溶液中通入少量实验①产生的气体 溶液
已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体。②向NaI溶液中通入少量实验①产生的气体,溶液变黄色。③取实验②生成的溶液滴在淀粉KI试纸上,试纸
下列说法在一定条件下可以实现的是( )①非金属置换金属的反应 ②弱酸反应可以生成强酸 ③没有水生成
下列说法在一定条件下可以实现的是( )①非金属置换金属的反应 ②弱酸反应可以生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④有单质
(6分)在足量的稀氯化亚铁溶液中 加入1~2滴液溴 振荡后溶液变为黄色。(1)甲同学认为这不是发生化
(6分)在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:____(填粒子的化
在常温下 发生下列几种反应:① 16H+ + 10Z— + 2XO4—= 2X2+ + 5Z2 +8
在常温下,发生下列几种反应:① 16H+ + 10Z— + 2XO4—= 2X2+ + 5Z2 +8H2O② 2A2+ + B2 = 2A3+ + 2B—③ 2B—+ Z2 = B2 + 2Z—根
(14分)黄铜矿( CuFeS2)是制取铜及其化合物的主要原料之一 还可以制备硫及铁的化合物。(1)
(14分)黄铜矿( CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。(1)、若冶炼铜的反应为:8 CuFeS2+21O28Cu+4FeO+2Fe2O3+16SO












