根据所学知识 回答下列问题:(1)写出电解食盐水的化学方程式 并用双线桥标出电子转移的方向和数目:_
| 根据所学知识,回答下列问题: (1)写出电解食盐水的化学方程式,并用双线桥标出电子转移的方向和数目:______该反应中氧化剂为______,还原剂为______. (2)漂白粉的有效成分是(填化学式)______.漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程为______. |
参考解答
(1)电解食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时生成氢氧化钠,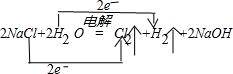 ;得电子化合价降低的物质是水,所以水是氧化剂,失电子化合价升高的物质是氯化钠,所以氯化钠是还原剂. 故答案为:  ;水;氯化钠; (2)漂白粉的有效成分是Ca(ClO)2;次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸,反应方程式为 Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO. 故答案为:Ca(ClO)2;Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO. |
相似问题
某溶液中含有的溶质是FeBr2 FeI2 若先向该溶液中通入一定量的氯气 再向反应后的溶液中滴加KS
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述正确的是( )①
北京市场销售的某种食用精制盐包装袋上有如下说明:产品标准GB5461产品等级一级 配 料食盐 碘
北京市场销售的某种食用精制盐包装袋上有如下说明:产品标准GB5461产品等级一级配料食盐、碘酸钾、抗结剂碘含量(以I计算)20~50mg kg分装日期 分装企业
下列变化需要加入某种还原剂才能实现的是( )A.Cl--→Cl2B.H2-→HClC.CaCl2-
下列变化需要加入某种还原剂才能实现的是( )A.Cl--→Cl2B.H2-→HClC.CaCl2-→CaCO3D.Fe3+-→Fe2+
某强酸性反应体系中 反应物和生成物共六种物质:O2 MnO4- H2O Mn2+ H2O2 H+.已
某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2只发生了如下过程:H2O2→O2.(1)该反应应选择的酸
已知下列物质氧化H2SO3时 自身发生如下变化:Cl2→2Cl- MnO4-→Mn2+ Cr2O72
已知下列物质氧化H2SO3时,自身发生如下变化:Cl2→2Cl-,MnO4-→Mn2+,Cr2O72-→2Cr3+,H2O2→2H2O.如果分别用等物质的量的这些物质氧化足量的H2SO3,












