某强酸性反应体系中 反应物和生成物共六种物质:O2 MnO4- H2O Mn2+ H2O2 H+.已
| 某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2 只发生了如下过程:H2O2→O2. (1)该反应应选择的酸是:______(填序号). A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸. (2)该反应中发生还原反应的过程是:______→______. (3)写出该反应配平的离子方程式并标出电子转移的方向和数目:______ (4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为______mol. (5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为______. (6)H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是______. |
参考解答
| (1)这是MnO4-酸性环境下氧化H2O2的反应, A、盐酸也会被MnO4-氧化,故A错误; B、浓硫酸没有必要,这里主要利用硫酸的酸性就可以了,不需要浓硫酸,浓硫酸是利用它的吸水性、强氧化性等情况才用的,故B错误; C、稀硫酸可以提供酸性环境并且不易被高锰酸根氧化,故C正确; D、醋酸酸性弱,还可能被MnO4-氧化,故D错误. 故选C. (2)该反应过程中,MnO4-的Mn元素化合价降低,在反应中被还原生成Mn2+,发生还原反应, 故答案为:MnO4-;Mn2+; (3)该反应过程中,高锰酸根的氧化性和双氧水的还原性导致二者间发生氧化还原反应, 即2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,在该反应中,化合价升高值=化合价降低值=转移电子数=10, 电子转移情况如下: 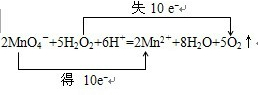 , 故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,  ; (4)上述反应中生成5mol氧气转移电子10mol,当反应中有6.72L(标准状况)即0.3mol氧气生成时,则转移的电子为0.6mol,故答案为:0.6; (5)反应KCN+H2O2+H2O═A+NH3↑中,根据原子守恒可知生成物A的化学式为KHCO3,故答案为:KHCO3; (6)H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性,所以H2O2被称为绿色氧化剂, 故答案为:H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性. |
相似问题
已知下列物质氧化H2SO3时 自身发生如下变化:Cl2→2Cl- MnO4-→Mn2+ Cr2O72
已知下列物质氧化H2SO3时,自身发生如下变化:Cl2→2Cl-,MnO4-→Mn2+,Cr2O72-→2Cr3+,H2O2→2H2O.如果分别用等物质的量的这些物质氧化足量的H2SO3,
下列反应既是氧化还原反应 又是吸热反应的是( )A.铝片与稀H2SO4反应B.Ba(OH)2?8H
下列反应既是氧化还原反应,又是吸热反应的是( )A.铝片与稀H2SO4反应B.Ba(OH)2?8H2O与NH4Cl反应C.灼热的炭与CO2反应D.甲烷在O2中的燃烧反应
中新网沈阳4月18日 沈阳市公安局查获掺入非食品添加剂的毒豆芽二十余吨.经检测 毒豆芽中含有亚硝酸钠
中新网沈阳4月18日,沈阳市公安局查获掺入非食品添加剂的毒豆芽二十余吨.经检测,毒豆芽中含有亚硝酸钠(NaNO2)等有害物质,过量或长期食用含亚硝酸钠
锌粉可将水体中的硝酸盐还原 其反应原理可以用以下离子方程式表示______NO3-+______OH
锌粉可将水体中的硝酸盐还原,其反应原理可以用以下离子方程式表示______NO3-+______OH-+______Zn+______H2O→______NH3+______Zn(OH)42-(1)配平上述
“嫦娥二号”的制造使用了铝-锂 铝-镁等多种合金材料 火箭推进剂中发生反应:N2O4+2N2H4=3
“嫦娥二号”的制造使用了铝-锂、铝-镁等多种合金材料,火箭推进剂中发生反应:N2O4+2N2H4=3N2+4H2O.下列有关叙述不正确的是( )A.锂、铝、镁都属












