锌粉可将水体中的硝酸盐还原 其反应原理可以用以下离子方程式表示______NO3-+______OH
| 锌粉可将水体中的硝酸盐还原,其反应原理可以用以下离子方程式表示 ______NO3-+______OH-+______Zn+______H2O→______NH3+______Zn(OH)42- (1)配平上述离子反应方程式,标出电子转移的方向和数目; (2)某河段同时受酸性物质污染,若锌粉与其还原的硝酸根离子的物质的量之比为4:1,则锌粉被氧化为______离子,硝酸根离子被还原为______(均用化学符号表示); (3)将锌粉改为铝粉在上述酸性条件下还原硝酸盐,若还原等物质的量的硝酸根离子,锌与铝的物质的量之比为______; (4)现已合成了有Zn-Zn共价键的化合物,由Zn2O制Zn2Cl2可选用的试剂是______. a.盐酸 b.氯气 c.KClO3. |
参考解答
(1)氮元素化合价从+5价变化为-3价,锌元素化合价从0价变化为+2价,先求最小公倍数为8,锌和锌离子前乘4,观察配平,得到离子方程式为:NO3-+7OH-+4Zn+6H2O=NH3+4Zn(OH)4-;电子转移总数为8,标注电子转移为: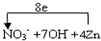 , 故答案为:1;7;4;6;1;4; 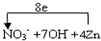 ; (2)若锌粉与其还原的硝酸根离子的物质的量之比为4:1,依据电子守恒,Zn~Zn2+~2e-;设硝酸根中氮元素化合价变化为x,NO3-~N~(5-x),依据电子守恒得到4×2=1×(5-x),x=-3,还原产物为NH4+,故答案为:Zn2+;NH4+; (3)还原等量硝酸根离子,锌和铝失电子相同物质的量之比为3:2,故答案为:3:2; (4)b.氯气 c.KClO3 ,都是强氧化剂能氧化Zn2O为高价态不能制备Zn2Cl2 ,由Zn2O制Zn2Cl2可选用的试剂选用a(HCl),故答案为:a. |
相似问题
“嫦娥二号”的制造使用了铝-锂 铝-镁等多种合金材料 火箭推进剂中发生反应:N2O4+2N2H4=3
“嫦娥二号”的制造使用了铝-锂、铝-镁等多种合金材料,火箭推进剂中发生反应:N2O4+2N2H4=3N2+4H2O.下列有关叙述不正确的是( )A.锂、铝、镁都属
现有下列10种物质:①铁片;②饱和食盐水;③液态硫酸;④乙醇;⑤干冰;⑥熔融硝酸钾;⑦碳酸钙固体;⑧
现有下列10种物质:①铁片;②饱和食盐水;③液态硫酸;④乙醇;⑤干冰;⑥熔融硝酸钾;⑦碳酸钙固体;⑧铝条;⑨苛性钠;⑩石墨.(1)用序号回答:能导
钢铁“发蓝”的过程可以用如下化学方程式表示.下列说法正确的是①3Fe+NaNO2+5NaOH═3Na
钢铁“发蓝”的过程可以用如下化学方程式表示.下列说法正确的是①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑②[x]Na2FeO2+[y]NaNO2+[z]H2O═[m]Na2Fe2O4+[n]N
关于如下反应HgS+O2 △ . Hg+SO2下列叙述不正确的是( )A.该反应是置换反应B.
关于如下反应HgS+O2△ Hg+SO2下列叙述不正确的是( )A.该反应是置换反应B.该反应转移了4e-C.Hg是被还原得到的产物D.HgS既是还原剂又是氧化剂
已知反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 据此判断下列说法正确( )A.
已知反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,据此判断下列说法正确( )A.KCl为还原产物B.HCl全部发生氧化反应C.该反应表明氧化性KClO3比Cl2强D












