钠是活泼的碱金属元素 钠及其化合物在生产和生活中有广泛的应用。完成下列计算:(1)叠氮化钠(NaN3
| 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。 完成下列计算: (1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊。若78克叠氮化钠完全分解,产生标准状况下氮气___________________L 。 (2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。计算溶液中氢氧化钠的物质的量浓度______________________(忽略液体体积变化)。 (3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O。己知通入二氧化碳112 L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5。若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量的最大值。 (4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
试回答: 该铵盐的成分为_______________________________。 该铵盐中氮元素的质量分数为:_______________________________(须列式计算)。 |
参考解答
| (1)(3分) 40.32;(2)(3分) 0.25mol/L;(3)(6分) 14mol、10mol; (4)(4分)(NH4)2SO4与NH4HSO4的混合物;16.7% |
试题分析:(1) 叠氮化钠(NaN3)受撞击分解产生钠和氮气,该反应的化学方程式是2NaN3=2Na+3N2↑。78克叠氮化钠的物质的量是78g÷65/mol=1.2mol,所以生成氮气的物质的量是1.2mol× 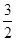 =1.8mol,因此在标准状况下的体积是1.8mol×22.4L/mol=40.32L。 =1.8mol,因此在标准状况下的体积是1.8mol×22.4L/mol=40.32L。(2)设5.05 g钠-钾合金中钠和钾的物质的量分别是x和y,则23x+39y=5.05。根据电子得失守恒可知,x+y=0.075mol×2,解得x=0.05mol、y=0.10mol,因此根据原子守恒可知,氢氧化钠的物质的量是0.05mol,所以氢氧化钠的浓度是0.05mol÷0.2L=0.25mol/L。 (3)己知通入二氧化碳112 L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5,这说明溶液中还有氢氧化钠。112LCO2的物质的量是5mol,设溶液中氢氧化钠的物质的量是n,则根据2NaOH+CO2=Na2CO3+H2O可知与氢氧化钠反应的CO2是0.5n,所以与NaAl(OH)4反应的CO2是5-0.5n,生成氢氧化铝是2×(5-0.5n),[2×(5-0.5n):5=4:5,解得x=6mol。当通入CO2的物质的量是224L÷22.4L/mol=10mol时,氢氧化钠消耗3mol氢氧化钠,生成3mol碳酸钠。剩余10mol-3mol=7molCO2与NaAl(OH)4反应,生成氢氧化铝是14mol,碳酸钠是7mol,所以共计生成碳酸钠是10mol (4)当铵盐质量是50.0g时没有氨气溢出,这说明铵盐中一定还有硫酸氢铵。当铵盐的质量是10.0g和20.0g时放出的氨气相同,这说明铵盐还有硫酸铵。因为在(NH4)2SO4与NH4HSO4的混合物中,NaOH优先与NH4HSO4发生中和反应:2 NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O 过量的NaOH再与(NH4)2SO4反应(加热)产生NH3 (NH4)2SO4+2NaOH  Na2SO4+2NH3↑+2H2O Na2SO4+2NH3↑+2H2ONH3被浓硫酸吸收使其质量增加:2 NH3+H2SO4=(NH4)2SO4 设NaOH的物质的量为a,铵盐中(NH4)2SO4的质量分数为x 10g铵盐与NaOH(过量)反应生产mg氨气,因此有: 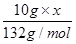 ×2×17g/mol+ ×2×17g/mol+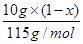 ×17g/mol=mg ① ×17g/mol=mg ①20g铵盐与NaOH(过量)反应生产mg氨气,因此有: [a- 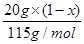 ×17g/mol=mg ② ×17g/mol=mg ②30g铵盐与NaOH(过量)反应生产1.29g氨气,因此有: [a- 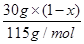 ×17g/mol=1.29g ③ ×17g/mol=1.29g ③联立①②③,解之得x=0.50 所以10g铵盐中氮元素的质量为: 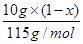 ×2×14g/mol+ ×2×14g/mol+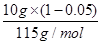 ×14g/mol=1.67g ×14g/mol=1.67g因此铵盐中氮元素的质量分数为16.7% |
相似问题
下列有关钠的叙述正确的是 ( )①钠在空气中燃烧生成氧化钠 ②金属钠可以保存在石蜡油或煤
下列有关钠的叙述正确的是()①钠在空气中燃烧生成氧化钠②金属钠可以保存在石蜡油或煤油中③钠在自然界中以化合态形式存④钠投入硫酸铜溶液中反应生成
将足量CO2气体通入水玻璃(Na2SiO3溶液)中 然后加热蒸干 再在高温下充分灼烧 最后所得的固体
将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是A.Na2CO3、Na2SiO3 B.Na2CO3、SiO2C.Na2SiO3D.SiO2
取a g某物质在氧气中完全燃烧 将其产物跟足量的过氧化钠固体完全反应 反应后固体的质量恰好也增加了a
取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g.下列物质中不能满足上述结果的是( )。A.
将4.34gNa Na2O Na2O2的混合物与足量的水反应 在标准状况下得到672mL混合气体 该
将4 34gNa、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体,该混合气体通过放电,恰好完全反应,则它们的物质的量之比为A.1:1:1B
为了降低宇航员所在的轨道舱和返回舱内二氧化碳的浓度 同时保证舱内宇航员吸收新鲜的氧气 请问舱内放入下
为了降低宇航员所在的轨道舱和返回舱内二氧化碳的浓度,同时保证舱内宇航员吸收新鲜的氧气,请问舱内放入下列哪种物质能满足上述要求( )A.H2OB.Na2O2C












