甲 乙两个探究性学习小组 他们拟测定过氧化钠样品(含少量的Na2O)的纯度。(1)甲组同学拟选用图1
甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量的Na2O)的纯度。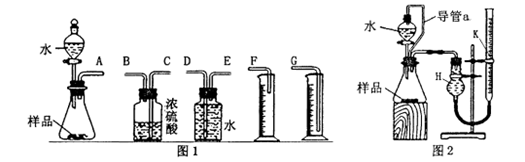 (1)甲组同学拟选用图1实验装置完成实验: ①写出实验中所发生反应的化学方程式 ; ②该组同学选用最简单装置的连接顺序是: A接( ),( )接( ),( )接( )(填接口字母,可不填满); (2) 乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气, 也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了图2所示的实验装置。 ①装置中导管a的作用是: 。 ②实验结束后,在读取量气管k中液面读数时,你认为最合理的顺序是 (用A、 B、C字母表示) A. 视线与量气管k中凹液面的最低点相平 B. 等待实验装置冷却 C. 上下移动量气管k,使k中液面与H中的液面相平 ③若实验中样品的质量为wg,实验前后量气管k中液面读数分别为V1、V2(换算成标况)。则样品的纯度为_______ (含w、V的表达式)。 |
参考解答
| (1)① Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑(2分);②EDG (1分) (2)①可以使分液漏斗内气体的压强与锥形瓶内气体压强相等,打开分液漏斗旋塞时水能顺利流下,消除由于加入水引起的氧气体积误差(1分)②BCA (1分) ③Na2O2%=195×(V1-V2)/28w×100%(2分); |
试题分析:(1)甲组同学选用图1实验装置完成实验:该实验所发生反应的化学方程式为:Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑;②实验产生的氧气的体积可以采用排出水的体积的方法来测定,所以该组同学选用最简单装置的连接顺序是A接E,D接G,可以不用浓硫酸做干燥器,因为采用的是排水法;(2)水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,a的作用就是用来消除这一缺点,即a的作用是可以使分液漏斗内气体的压强与锥形瓶内气体压强相等,打开分液漏斗旋塞时水能顺利流下,消除由于加入水引起的氧气体积误差;实验结束后,在读取量气管k中液面读数时,应该等待实验装置冷却,然后上下移动量气管k,使k中液面与H中的液面相平,读数是要让视线与量气管k中凹液面的最低点相平,故合理的顺序为BCA;③若实验中样品的质量为wg,实验前后量气管k中液面读数分别为V1、V2(换算成标况),所以生成氧气的体积为(V1-V2)mL,根据2Na2O2+2H2O=4NaOH+O2↑即生成氧气的质量为32×(V1-V2)×156/22.4g,所以过氧化钠的质量m=156×(V1-V2)/22.4,即样品的纯度为:156×(V1-V2)/22.4×100%,化简为195×(V1-V2)/28w×100%。 点评:本题考查了钠及其化合物的性质,该考点是高考考查的重点和难点,本题侧重考查学生对实验的分析能力和计算能力,该题难度中等。 |
相似问题
钠是活泼的碱金属元素 钠及其化合物在生产和生活中有广泛的应用。完成下列计算:(1)叠氮化钠(NaN3
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。完成下列计算:(1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊
下列有关钠的叙述正确的是 ( )①钠在空气中燃烧生成氧化钠 ②金属钠可以保存在石蜡油或煤
下列有关钠的叙述正确的是()①钠在空气中燃烧生成氧化钠②金属钠可以保存在石蜡油或煤油中③钠在自然界中以化合态形式存④钠投入硫酸铜溶液中反应生成
将足量CO2气体通入水玻璃(Na2SiO3溶液)中 然后加热蒸干 再在高温下充分灼烧 最后所得的固体
将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是A.Na2CO3、Na2SiO3 B.Na2CO3、SiO2C.Na2SiO3D.SiO2
取a g某物质在氧气中完全燃烧 将其产物跟足量的过氧化钠固体完全反应 反应后固体的质量恰好也增加了a
取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g.下列物质中不能满足上述结果的是( )。A.
将4.34gNa Na2O Na2O2的混合物与足量的水反应 在标准状况下得到672mL混合气体 该
将4 34gNa、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体,该混合气体通过放电,恰好完全反应,则它们的物质的量之比为A.1:1:1B












